文献解析
阿霉素(Doxorubicin)是一种广泛应用于临床的蒽环类化疗药物,具有广谱的抗肿瘤活性,但其存在严重的心脏毒性,可导致急性或迟发性心力衰竭。已有研究表明,阿霉素能够靶向拓扑异构酶 IIβ,增加活性氧的产生,引发线粒体功能障碍,进而导致心肌细胞丧失和心力衰竭。
在临床上,阿霉素诱导的心肌病具有剂量累积依赖性,且可能在治疗后很长时间才会发生。当阿霉素的累积剂量达到 600 毫克/平方米时,发生阿霉素诱导的心肌病的风险会增加到 36%。血液中升高的心房钠尿肽(ANP)和脑钠肽(BNP)水平是迟发性心脏毒性的常见生物标志
物,其水平显著高于肌钙蛋白 T(cTnT)和肌钙蛋白 I(cTnI)。
尽管存在阿霉素的给药指南,但由于缺乏可靠的预测性生物标志物,无法有效预防阿霉素诱导的心肌病。已有的心血管疾病情况可提供一些指导意见,但由于该病具有迟发性的特点,阿霉素诱导的心肌病对于癌症患者而言仍然是一个风险因素,阿霉素诱导的心肌损伤机制仍未完全阐明。
文献来源

近日,上海交通大学医学院附属第九人民医院和上海精准医学研究院张家毓教授、雷鸣教授和心内科张俊峰教授团队合作在《Advanced Science》杂志上发表了题为“线粒体数量决定阿霉素诱导心肌细胞的心脏毒性(Mitochondrial Amount Determines Doxorubicin-Induced Cardiotoxicity in Cardiomyocytes)” 的研究论文。
该研究利用人诱导多能干细胞来源的心肌细胞 (hiPSC-CMs)和动物模型,揭示了阿霉素心脏毒性的双重机制。本研究发现阿霉素诱导的心肌病(DIC)的毒性取决于线粒体的数量。从分子层面来看,线粒体 DNA(mtDNA)的泄漏会引发cGAS-STING的炎症反应以及心肌细胞的衰老。
项目研究
在随访阿霉素诱导的心脏损伤模型中,患者用药前外周血单个核细胞(PBMC)中的线粒体拷贝数与用药后全血中BNP(心衰标志物)的变化呈负相关。
作者进一步通过线粒体移植和YFP-Parkin介导的线粒体自噬手段构建了不同线粒体拷贝数的人hiPSC来源的心肌细胞,线粒体含量较高的心肌细胞(mitohigh)在阿霉素处理后表现出更强的存活能力,并伴随较少的mtDNA外漏,而线粒体拷贝数较低的心肌细胞(mitolow)则更容易进入凋亡。
这提示线粒体拷贝数可能成为预测阿霉素心脏毒性的潜在生物标志物。
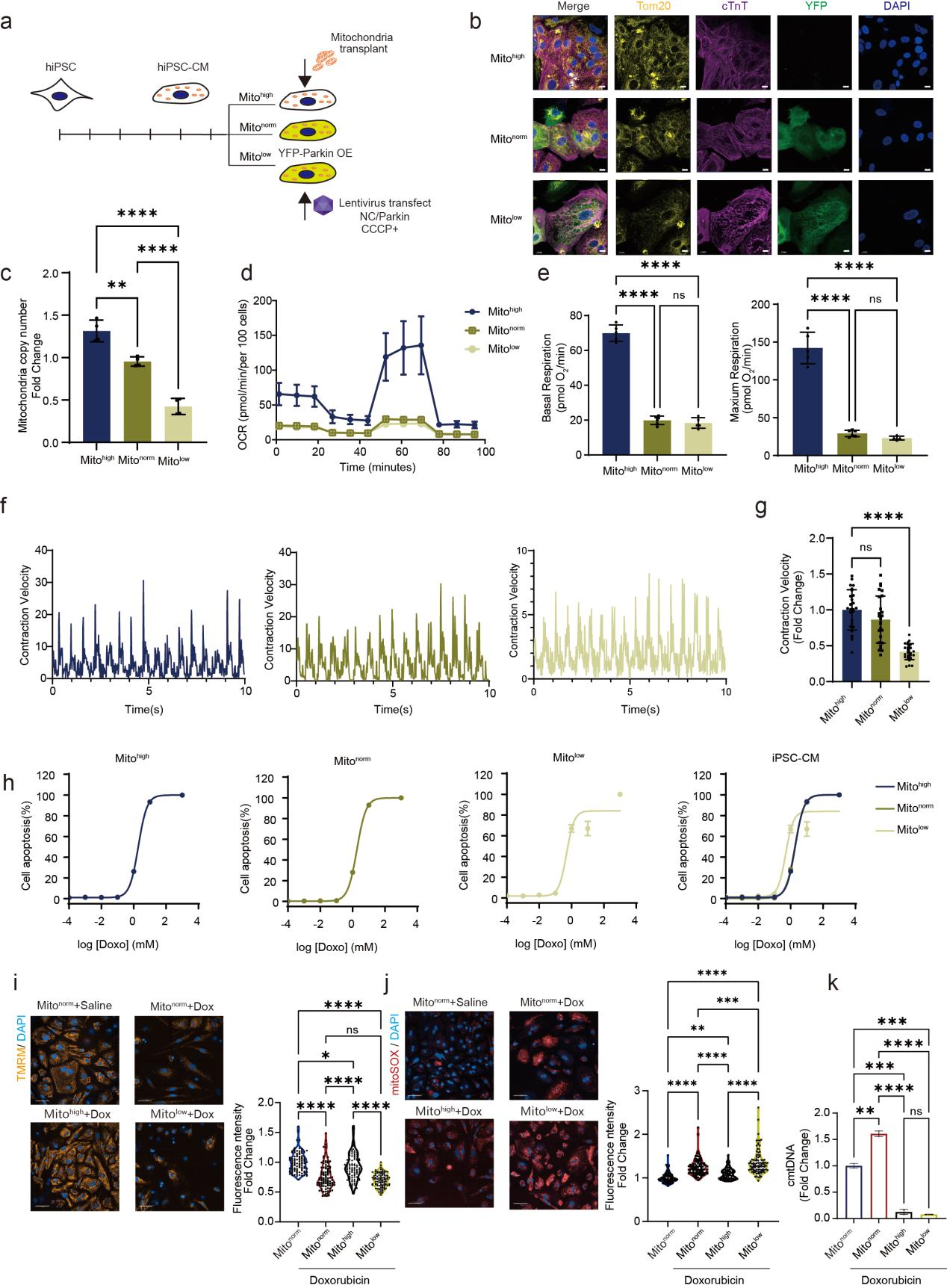
图1 不同线粒体DNA拷贝数的HiPSC‐CMs表现出不同程度的阿霉素耐受性
阿霉素直接攻击线粒体,破坏线粒体膜完整性,降低膜电位,并诱导线粒体通透性转换孔(mPTP)开放,导致活性氧(ROS)大量积累。这一过程中,线粒体DNA (mtDNA)泄漏至胞质,触发天然免疫系统cGAS-STING通路,从而激活下游炎症反应,引发心肌细胞的程序性死亡和衰老表型,最终导致心脏衰老和心脏功能的进一步恶化。

图2 线粒体DNA泄漏激活的cGAS‐STING通路促进心肌细胞的衰老
针对阿霉素引起的心肌损伤,作者探索了三种不同的救援策略,均能不同程度缓解心脏毒性。
作者将荧光标记的人hiPSC-CM来源线粒体原位注射至小鼠心脏,结果显示外源性线粒体可在心脏组织中存留超过一周,并促进线粒体生物合成,增强心肌抗氧化能力,并且在阿霉素作用后可以显著缓解小鼠心脏功能降低和线粒体的损伤。
同时作者通过构建小鼠心肌细胞Sting特异性敲除和过表达线粒体定位的DNase1,虽然无法挽救上游的线粒体膜电位降低和线粒体膜结构损伤,但抑制了阿霉素激活的mtDNA-cGAS-STING通路,缓解阿霉素引起的炎症反应和心肌细胞衰老。实验结果证明了阿霉素在体内对心肌细胞的损伤具有两层打击,可以通过线粒体移植和抑制mtDNA-cGAS-STING通路进行心肌细胞功能的挽救。
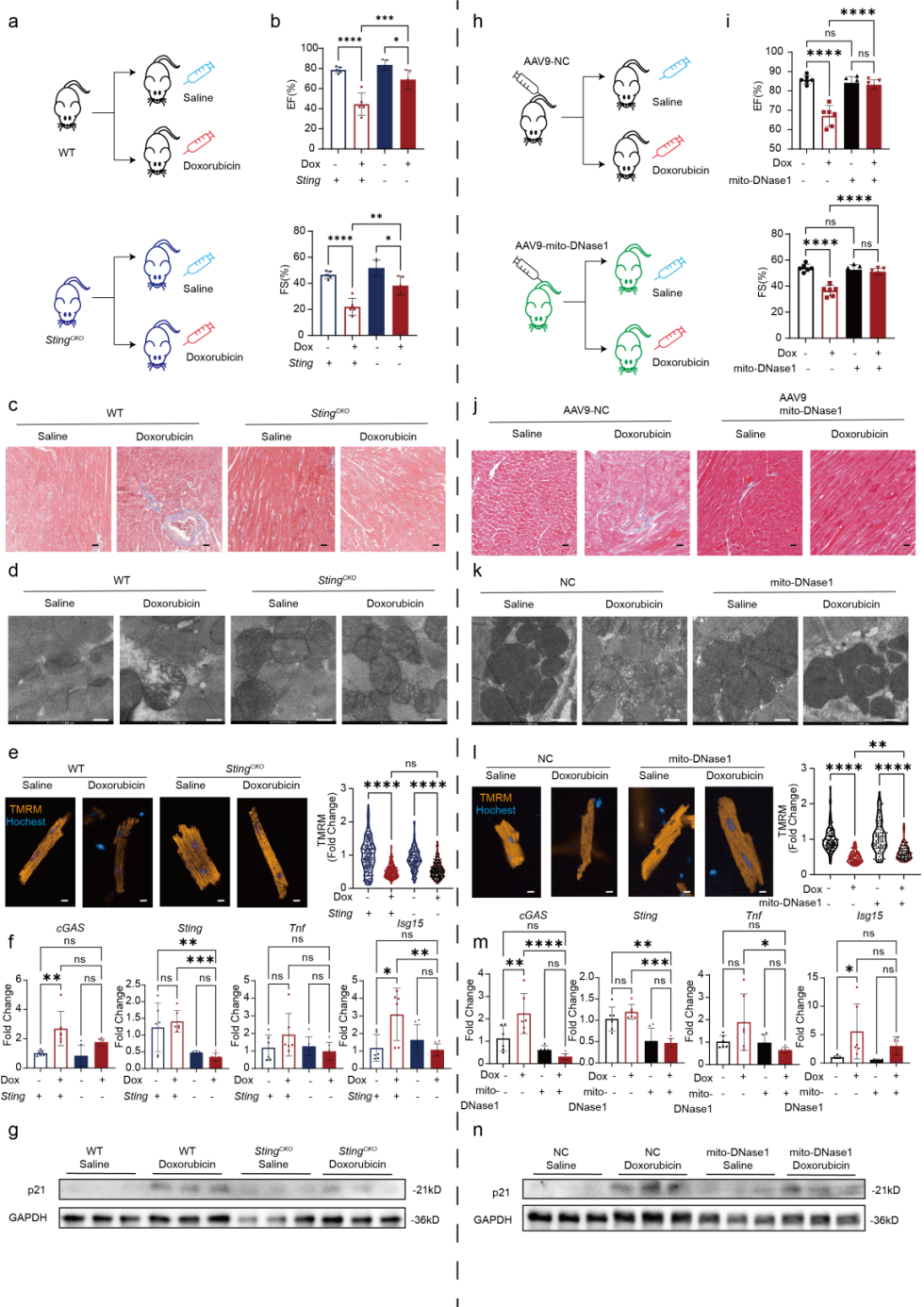
图3 心肌特异性STING敲除和线粒体靶向DNase1的过表达均能对抗阿霉素诱导的心脏毒性
研究结论
综上所述,本研究证明了线粒体含量决定了心肌对阿霉素的易感性。从分子层面来看,阿霉素通过打开线粒体通透性转换孔(包括BAX、BAK 和VDAC)破坏了线粒体膜的完整性,从而导致线粒体 DNA(mtDNA)泄漏到细胞质中。随后cGAS- STING通路的激活会促使心肌细胞衰老。通过基因敲除心肌中的STING,或者通过过表达线粒体脱氧核糖核酸酶 1(mito-DNase1)来降解细胞质中的mtDNA,又或是进行线粒体移植,均可阻止cGAS- STING通路的激活,并挽救心脏功能障碍。
传统观点认为阿霉素心脏毒性主要由氧化应激和DNA损伤驱动,而本研究首次系统性地揭示了mtDNA泄漏-免疫激活轴在心肌损伤中的核心作用,并提出线粒体移植、mtDNA清除和cGAS-STING抑制作为潜在的干预策略。
这一发现不仅拓展了对蒽环类药物心脏毒性的理解,也为个体化心脏保护策略提供了新方向。此外,该研究填补了阿霉素心肌病与线粒体拷贝数相关性研究的空白,并首次提出PBMC线粒体拷贝数可能作为预测阿霉素心脏毒性的生物标志物,这对临床上高风险患者的早期筛查和预防具有重要意义。
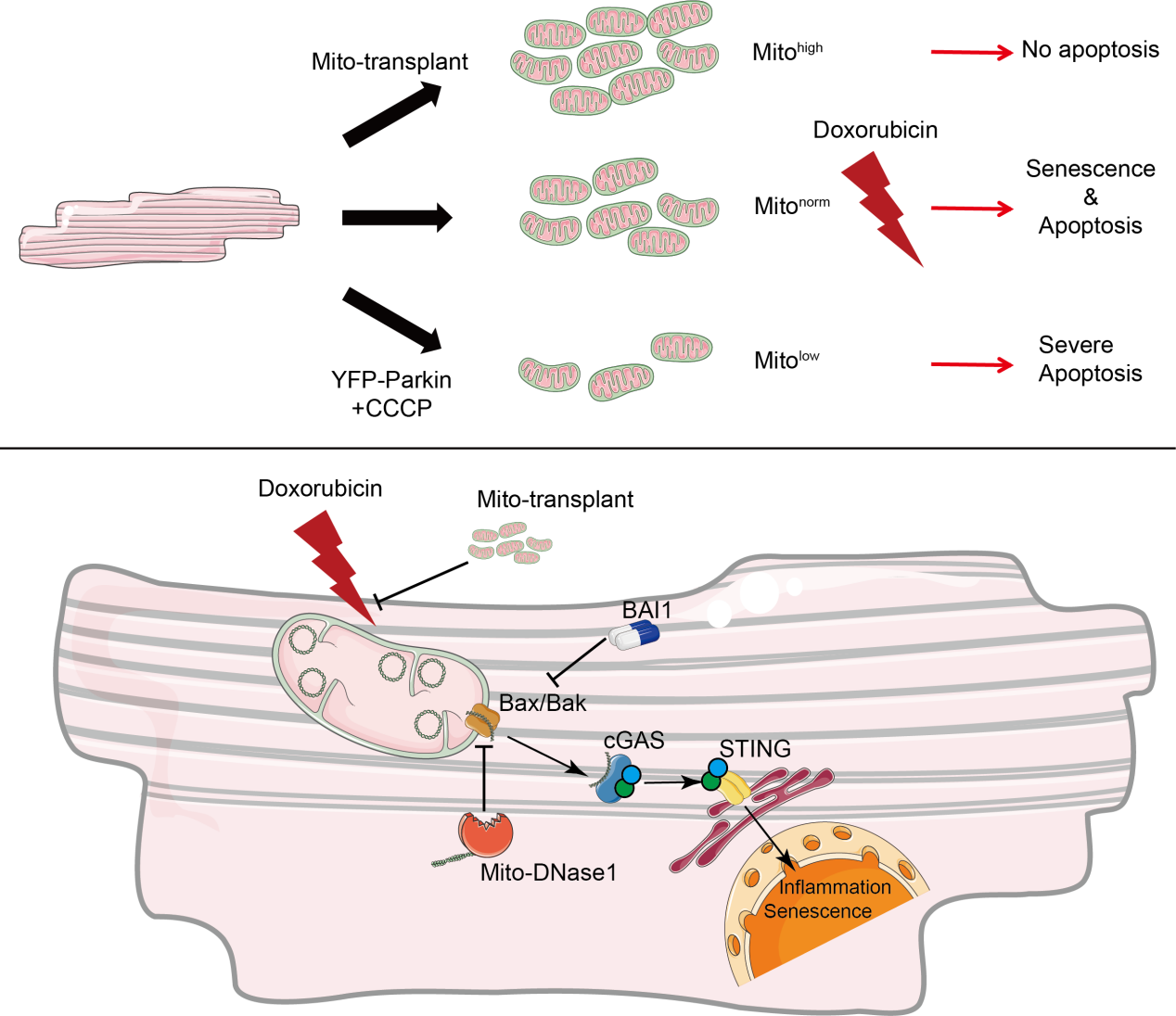
图4 mtDNA‐cGAS‐STING通路在阿霉素损伤中的信号机制及治疗策略
吉满助力
本研究中所用的AAV9‐cTnT由吉满生物(Genomeditech)提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
原文引用
“To overexpress mito‐DNase1, 2 weeks prior to Dox induction, mice received a 1E11 vg single i.v. injection of adeno‐associated serotype 9 (AAV9) virus carrying cardiac troponin T (cTnT) promoter‐driven mito‐DNase1 cDNA (AAV9‐mito‐DNase1). Empty AAV9‐cTnT served as vector control (AAV9‐Vector) (Genomeditech).”
文献原文
https://pmc.ncbi.nlm.nih.gov/articles/PMC11948046/
来源:课题组供稿














