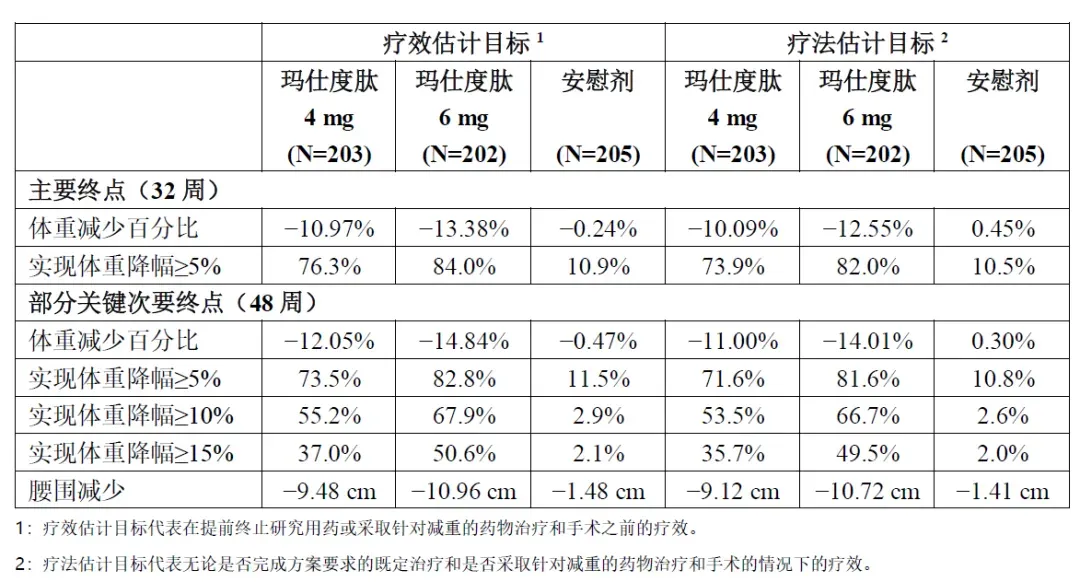
根据信达生物新闻稿介绍,本次获批主要基于一项在超重或肥胖受试者中开展的 III 期注册临床研究(GLORY-1)的研究结果。该研究结果已于 2025 年发表于《新英格兰医学杂志》。 该研究于2024年顺利达成主要研究终点和所有关键次要终点,研究结果显示在 基于疗效估计目标,第48周时,玛仕度肽4mg、6mg和安慰剂组体重相对基线百分比变化的均值分别为−12.0%、−14.8%和−0.5%;体重相对基线下降≥5%的受试者比例分别为73.5%、82.8%和11.5%;体重相对基线下降≥15%的受试者比例分别为37.0%、50.6%和2.1%;腰围相对基线变化值的均值分别为−9.5cm、−11.0cm和−1.5cm。 此外,玛仕度肽可明显降低超重或肥胖受试者的肝脏脂肪含量。在基线肝脏脂肪含量≥10%的受试者中,第48周时,玛仕度肽4 mg、6 mg和安慰剂组受试者全肝平均脂肪含量相对基线的百分比变化均值分别为−65.85%、−80.24%和−5.27%。 GLORY-1研究结果已在美国糖尿病学会年会(ADA)亮相,并在《新英格兰医学杂志》发表,获得行业专家学者的广泛关注。 值得一提的是,此次获批的玛仕度肽注射笔在便利性和安全性上都有着较大的提升。用户在使用过程中,全程看不到针头,有效缓解用户对注射的焦虑,并且即用即抛,避免了更换过程中引起的药物污染风险。同时,该装置笔还通过创新的X切面技术,实现了无痛感注射。 信达早在 2019 年 8 月就与礼来达成合作,在中国开发玛仕度肽。这也使其研发进度遥遥领先,如今领先于国内其他药企,率先获批上市。