文献解读

广西医科大学的南阿若教授课题组在《Molecular Cancer 》上发表题为“o8G-modifed circPLCE1 inhibits lung cancer progression via chaperone-mediated autophagy” 的研究性论文。
该研究表明,o8G修饰的circPLCE1可通过分子伴侣介导的自噬调控巨自噬的发生,最终抑制肺癌的进展。
研究方向:肺癌
据统计,肺癌在全球恶性肿瘤中的发病率和死亡率中均位居首位。现有研究已证实多种编码基因和非编码RNA参与肺癌的发生发展,且针对特异性基因产物的药物的开发极大地改善了肺癌患者的治疗,但肺癌的预后仍然较差。因此,深入研究肺癌发生的分子机制,阐明其精确的分子调控网络和信号通路至关重要。
环状RNAs(circRNAs)
环状RNAs(circRNAs)是一类由反向剪接产生的具有共价闭环的RNA,无5’cap和3’poly(A)尾结构,可作为microRNA(miRNA)的海绵,或是直接与mRNAs、蛋白结合,在肿瘤进展中发挥重要作用。其中,circPLCE1在亚砷酸钠诱导的恶性肿瘤细胞转化模型中表达失调,提示circPLCE1可能参与肺癌的发生发展。因此,本文选择circPLCE1作为研究对象,旨在系统阐明其在肺癌发生发展中的分子调控机制及其潜在临床应用价值。
项目研究
亚砷酸钠诱导人支气管黏膜上皮细胞(BEAS-2B-As)恶性转化模型的高通量测序结果表明,circPLCE1(hsa_circ_0019225)表达显著下调。
RT-qPCR定量结果显示,与BEAS-2B相比,非小细胞肺腺癌细胞系A549和H1299细胞中circPLCE1的表达下调更显著。因此,选择A549和H1299细胞用于后续体外研究。结合UCSC Genome Browser数据库及Sanger测序结果,研究人员成功验证其反向剪接位点。RNA稳定性实验显示,circPLCE1的半衰期比同源线性mRNA更长,稳定性更高,证实其具有环状结构。
临床样本分析显示,circPLCE1在肺癌组织中的表达显著低于癌旁组织,且在II-IV期肺癌组织中的表达显著低于I期肺癌组织,其表达水平与肿瘤大小呈负相关。Kaplan-Meier生存分析显示,circPLCE1低表达患者的总生存期比高表达患者更差。ROC分析揭示了circPLCE1作为肺癌预后生物标志物的潜在价值。
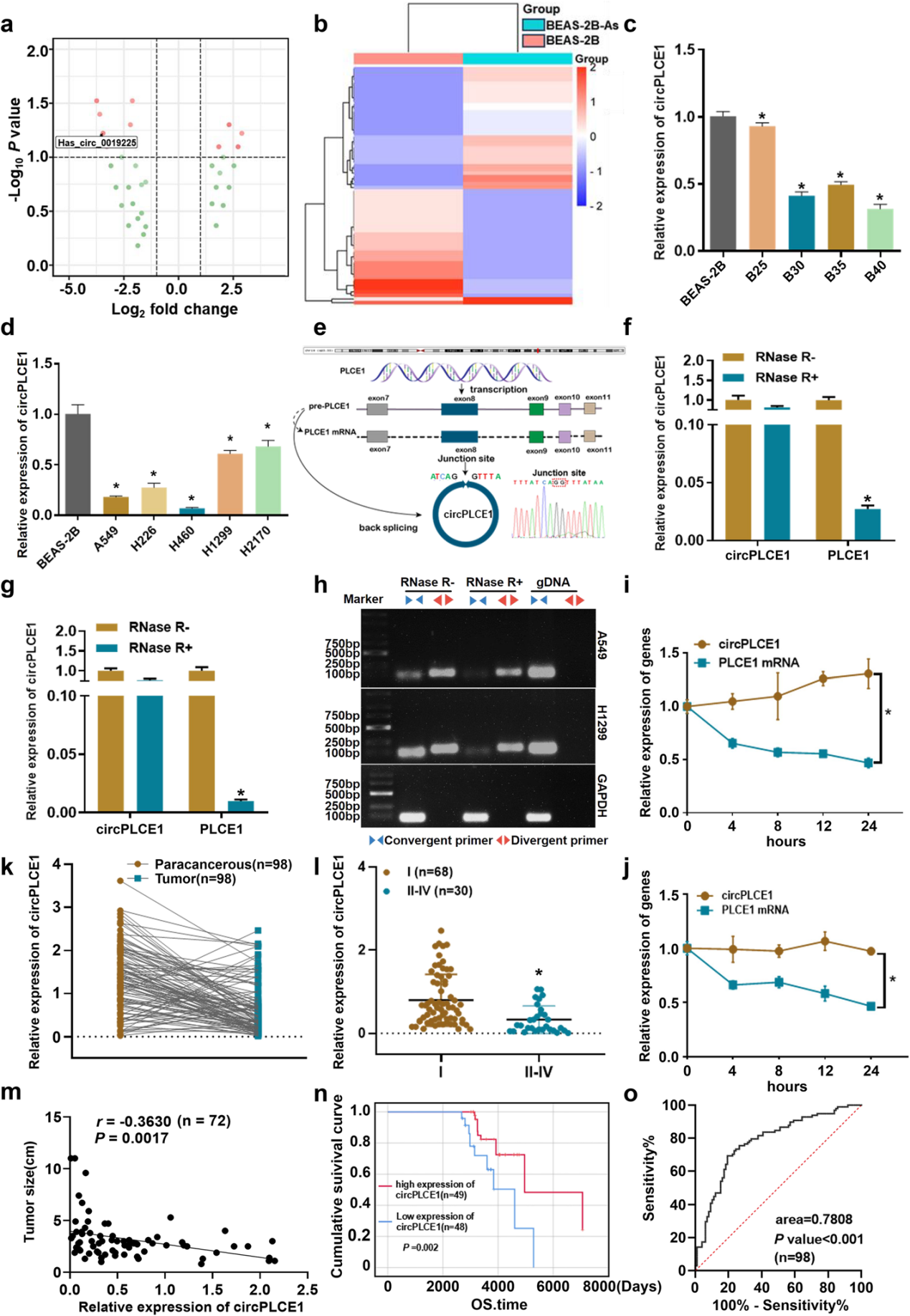
图1 circPLCE1在肺癌组织和细胞中显著下调
随着RNA修饰研究的深入,o8G修饰在调控RNA分子表达以及肿瘤发生发展中的重要作用已被揭示。
为了探究o8G修饰是否发生在circPLCE1上,作者使用o8G修饰特异性抗体进行了甲基化RNA免疫共沉淀(MeRIP)实验。结果显示,circPLCE1在抗o8G抗体组中显著富集,表明o8G修饰可以发生在circPLCE1上。紫外交联免疫共沉淀(CLIP)实验结果证实o8G修饰主要位于circPLCE1的第10个区域。
研究表明,o8G RNA氧化修饰是在哺乳动物细胞内活性氧(ROS)攻击mRNA中的鸟嘌呤从而产生的一种RNA修饰。鉴于梯度预实验结果,最终选用200µM的H2O2和 2mM的NAC用于细胞内细胞内ROS水平探究。
IF实验结果表明,H2O2增加了细胞内o8G修饰水平,NAC处理则相反,表明o8G修饰水平与细胞内ROS水平呈正相关。MeRIP实验中,H2O2处理组的circPLCE1 o8G修饰水平增加,表明ROS可诱导circPLCE1的o8G修饰。
此外,RNA稳定性实验结果显示,ROS诱导的o8G修饰导致circPLCE1的半衰期缩短,稳定性降低。
已有研究表明,AUF1可作为‘reader’优先识别RNA中的o8G修饰,从而影响RNA的稳定性,RNA免疫共沉淀(RIP)实验结果验证,circPLCE1可以直接与AUF1结合,且随着o8G修饰水平的增加,AUF1的富集程度也增加,表明AUF1特异性识别circPLCE1的o8G修饰。利用siRNA介导AUF1沉默后,o8G修饰导致circPLCE1的稳定性下降被逆转。
综上,ROS增加了circPLCE1的o8G修饰水平,而AUF1可以作为o8G修饰的‘reader’,介导circPLCE1稳定性和表达的下降。
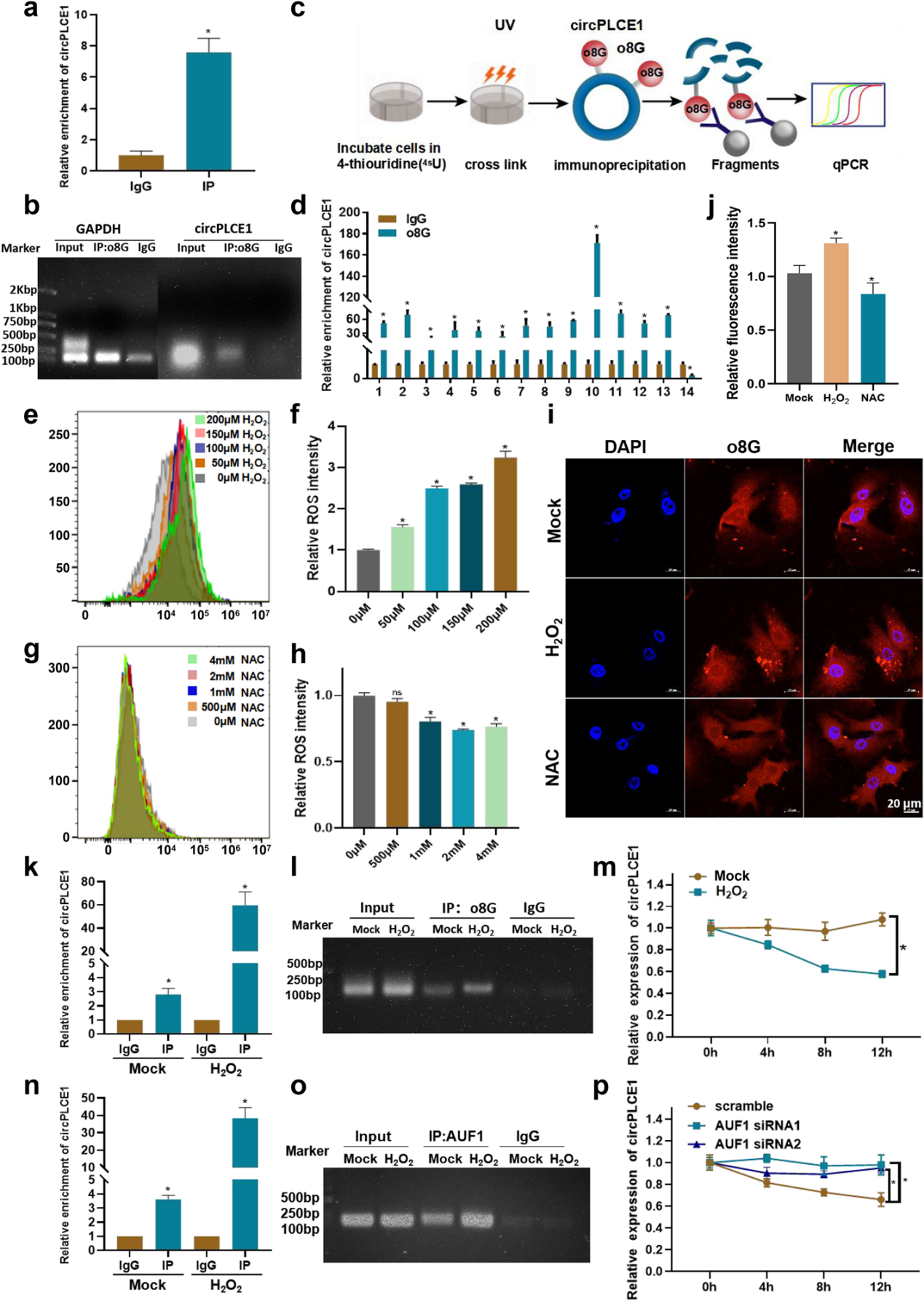
图2 circPLCE1的o8G修饰
随后,作者进行了一系列功能实验,以探究circPLCE1在体外的生物学功能。
EdU细胞增殖实验和CCK-8结果显示,circPLCE1沉默可显著促进肺癌细胞的增殖,增加肺癌细胞的活力;过表达则反之。
流式细胞术分析结果表明,circPLCE1沉默抑制细胞凋亡,并加速细胞周期进程;过表达则促进细胞凋亡,减缓细胞周期。
Transwell和伤口愈合实验发现,circPLCE1能够抑制肺癌细胞的迁移。综上所述,circPLCE1在体外能够显著抑制肺癌的进展。
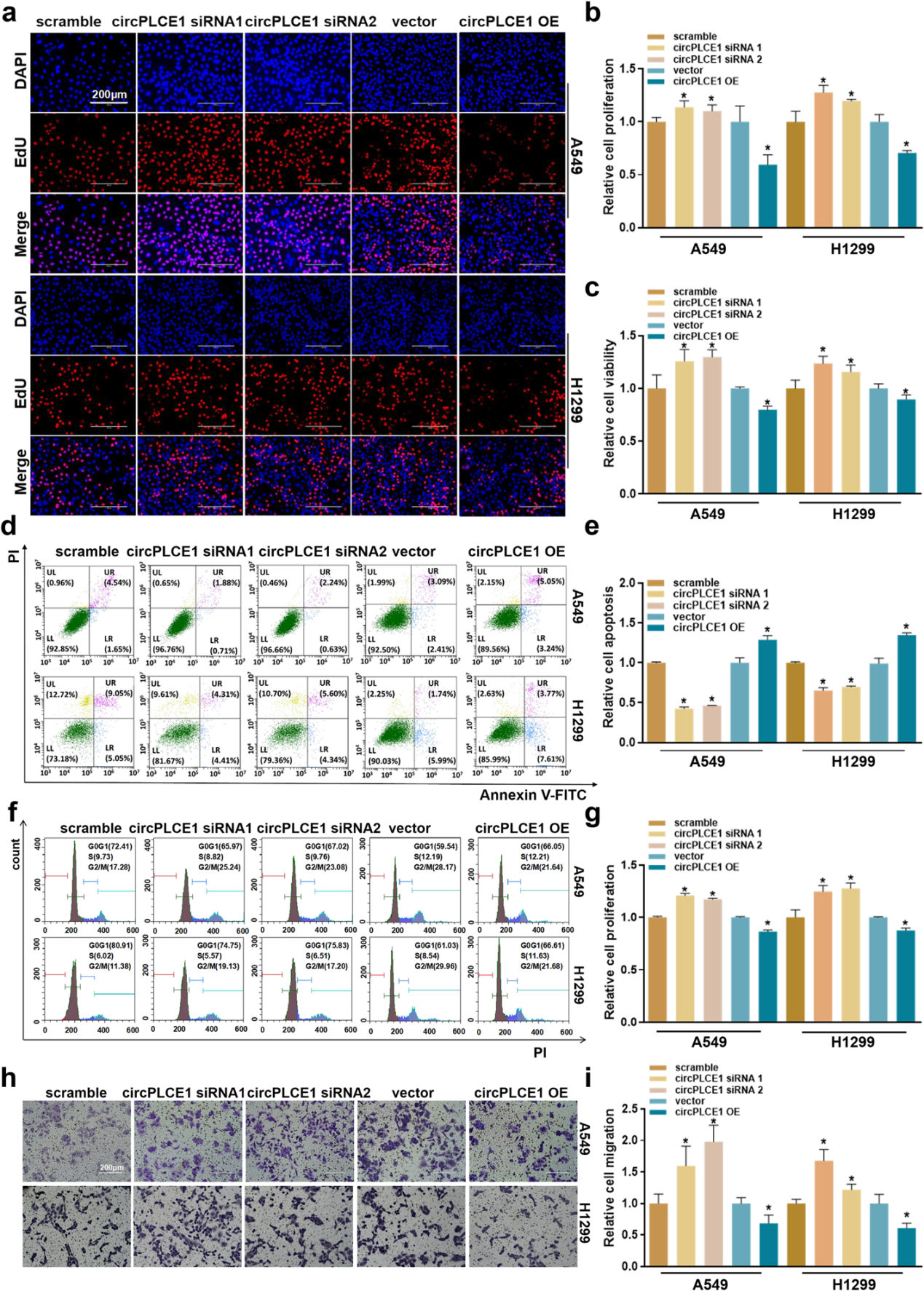
图3 circPLCE1在体外可显著抑制肺癌的进展
上述研究已阐明circPLCE1在体外具有显著抑制肺癌进展的生物学功能。为了进一步探究其体内的作用机制,作者建立了裸鼠皮下移植瘤模型。
实验进程
通过慢病毒转导构建稳定过表达circPLCE1的A549细胞系后,将该过表达细胞株和对照细胞株分别皮下注射至裸鼠右背部,每三天监测裸鼠的生存状态,并测量小鼠体重和肿瘤直径。
与对照组相比,过表达circPLCE1组小鼠的肿瘤体积更小且生长速度更慢。在肿瘤形成21天后处死裸鼠,取出肿瘤进行观察和称重。
与对照组相比,circPLCE1过表达组的肿瘤体积更小且重量更轻。随后,通过免疫组化检测裸鼠肿瘤中与肺癌进展相关蛋白的表达变化,包括增殖相关蛋白(Ki67)、凋亡相关蛋白(BCL2)和迁移相关蛋白(RhoA)。定量分析显示,与对照组相比,稳定过表达circPLCE1组的肿瘤中Ki67、BCL2和RhoA蛋白的表达均降低。这些结果表明,circPLCE1在体内能够显著抑制肺癌的进展。
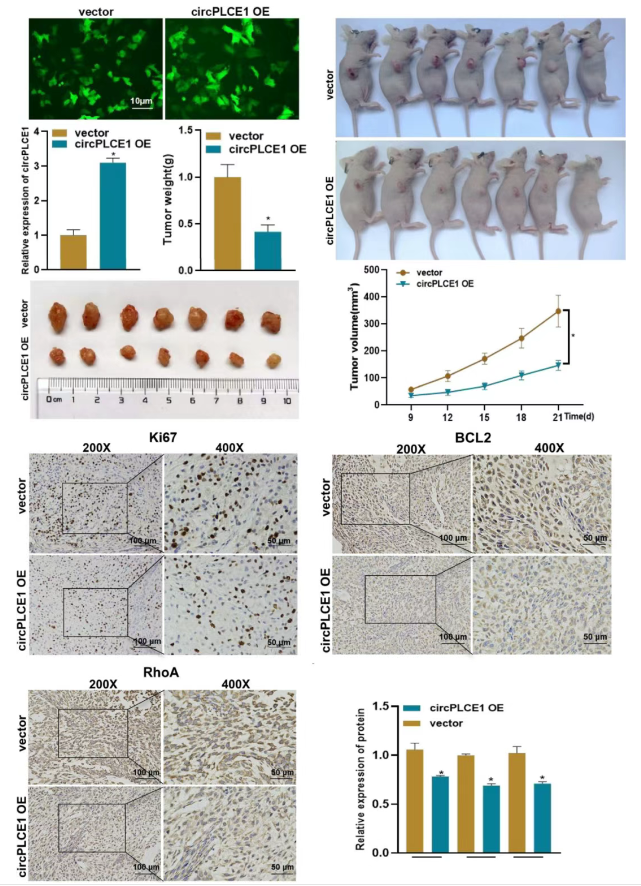
图4 circPLCE1在体内可显著抑制肺癌的进展
由于基因的亚细胞定位与其分子机制密切相关,作者通过核质分离和荧光原位杂交(FISH)实验发现,circPLCE1在细胞质和细胞核中均有表达,但主要定位于细胞质。
大量研究表明,circRNA通过与蛋白质直接结合是其发挥功能的重要机制。因此,通过标记RNA亲和纯化(TRAP)-质谱(MS)技术富集并鉴定了与circPLCE1直接结合的蛋白质,并结合KEGG富集分析算法,发现circPLCE1可能参与多种肿瘤相关通路,如内质网蛋白质加工等。
通过M-versus-A图(MA图)分析,作者选择了该通路中结合评分最高的HSC70进行深入研究。RIP实验进一步证实,circPLCE1能够直接与HSC70蛋白结合。
随后的Western blot分析显示,circPLCE1负调控HSC70蛋白的表达。对HSC70表达的免疫组化分析也表明,在稳定过表达circPLCE1的裸鼠肿瘤中,HSC70的表达显著降低。从裸鼠肿瘤中提取蛋白质并进行Western blot分析,结果显示,稳定过表达circPLCE1后,裸鼠肿瘤中的HSC70蛋白水平降低。TCGA数据库分析表明,HSC70高表达患者的生存率较低。
为了进一步探究circPLCE1如何调控HSC70,作者用CHX处理A549细胞以抑制蛋白质合成,发现circPLCE1显著缩短了HSC70的半衰期;而MG132处理后,circPLCE1无法调控HSC70的蛋白表达水平,表明circPLCE1通过泛素-蛋白酶体途径调控HSC70的蛋白表达。结合后续的免疫共沉淀(Co-IP)实验,可得出结论:circPLCE1能够影响HSC70蛋白的泛素化水平,并调控其泛素介导的降解。
此外,为评估circPLCE1是否可通过o8G修饰的方式调控HSC70蛋白表达,研究人员利用H2O2处理A549细胞并同时敲低AUF1,Western blot分析显示,H2O2处理增加了HSC70蛋白的表达,而AUF1敲低则逆转了HSC70蛋白表达的上调趋势。综上,o8G修饰降低了circPLCE1的稳定性,而circPLCE1通过直接结合降低了HSC70的稳定性和表达水平。
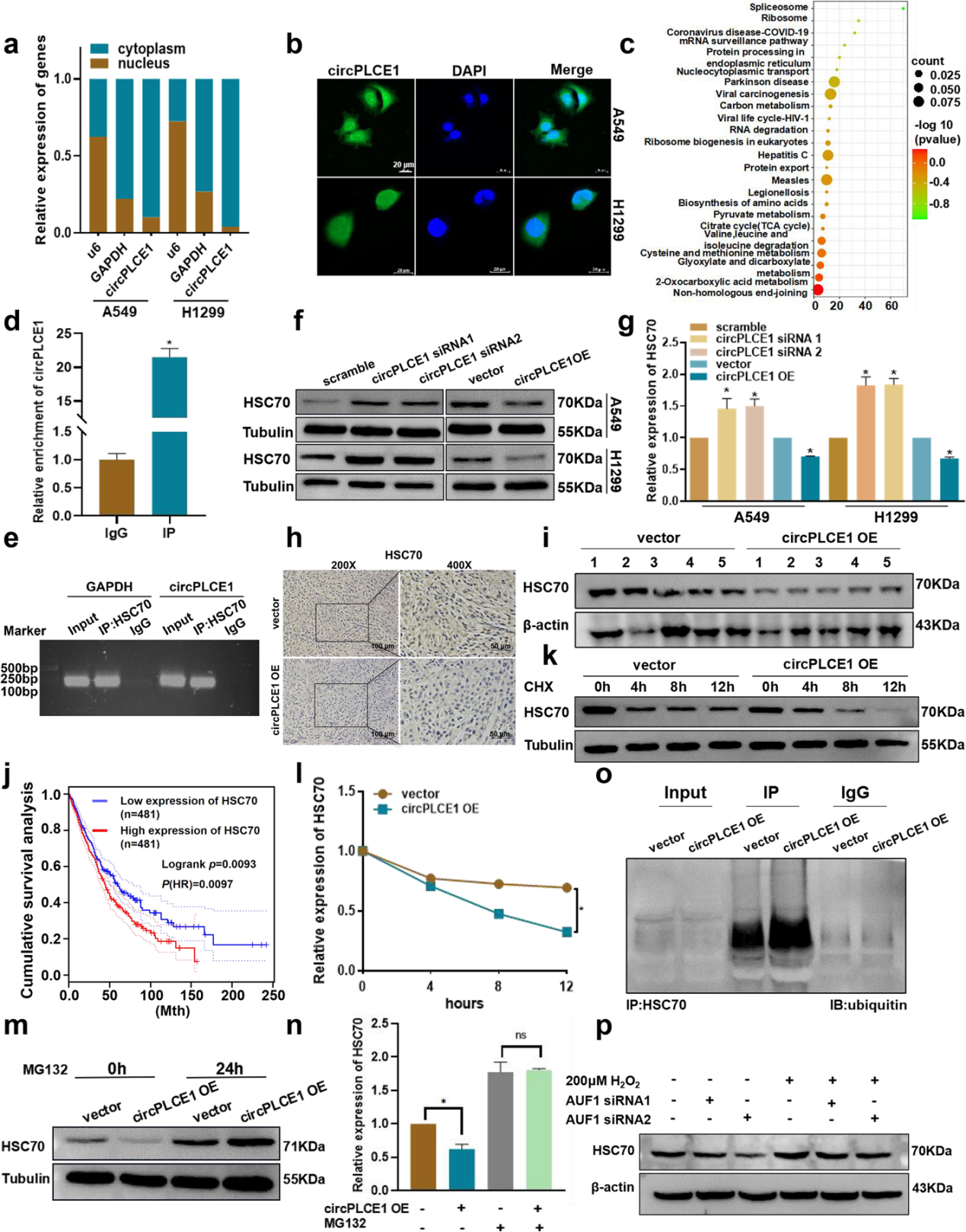
图5 circPLCE1靶向HSC70蛋白并调控其泛素化
HSC70不仅参与内质网蛋白质加工,也是分子伴侣介导的自噬(CMA)的关键蛋白。由于circPLCE1调控HSC70的蛋白表达水平,作者推测circPLCE1可能通过HSC70调控CMA通路,并选定两种已报道的CMA底物(PKM2和HK2)进行后续研究。
Co-IP和IF结果表明,HSC70与PKM2相互作用且共定位。CMA可在饥饿和氧化应激等条件下被激活。在A549和H1299细胞的血清饥饿处理组中,随着处理时间的延长(特别是在16小时和24小时时间点),HK2和PKM2的蛋白表达下降。同样,随着CMA特异性激动剂(AR7)作用浓度的增加,HK2和PKM2的蛋白表达下降。上述结果表明,CMA底物的表达水平与CMA活性相关,CMA活性增加后,底物表达水平下降。
随后,分别沉默或者过表达circPLCE1,发现circPLCE1可正向调控CMA底物蛋白(HK2和PKM2)的表达。免疫组化结果显示,体内也存在同样的调控。在过表达circPLCE1的同时,用20 μM AR7处理A549细胞24小时,Western blotting结果显示,AR7可逆转过表达circPLCE1对HK2和PKM2蛋白表达的上调,表明circPLCE1可能与CMA活性相关。在A549细胞中同时过表达circPLCE1和HSC70,HSC70过表达也可逆转circPLCE1过表达引起的HK2和PKM2表达增加,进一步说明circPLCE1通过HSC70调控CMA底物。
此外,作者使用含有KFERQ基序的融合蛋白可视化CMA活性,IF结果显示,过表达circPLCE1后,红色荧光斑点的数量显著减少,CMA活性降低。上述结果表明,circPLCE1可以通过HSC70调控CMA活性。
研究表明,CMA与巨自噬密切相关,但CMA与巨自噬之间的相互作用尚未阐明。因此,作者试图探究circPLCE1是否可以通过CMA通路调控巨自噬的关键蛋白,从而调控巨自噬。
Co-IP和IF实验显示,HSC70可以与巨自噬的关键蛋白(ATG5)相互作用且共定位。因ATG5含有三个KFERQ基序(KDVLR、DKVKK和FRIYQ),提示其可能是潜在的CMA底物蛋白。肺癌细胞经血清饥饿或是AR7处理后,ATG5蛋白表达下降,验证了ATG5作为CMA底物蛋白参与调控的猜想。
Western blot和免疫组化结果表明,过表达circPLCE1可促进ATG5的蛋白表达,AR7处理或者HSC70过表达则逆转该趋势。综上,circPLCE1可以通过靶向HSC70抑制CMA活性,并通过CMA通路增加ATG5蛋白表达。
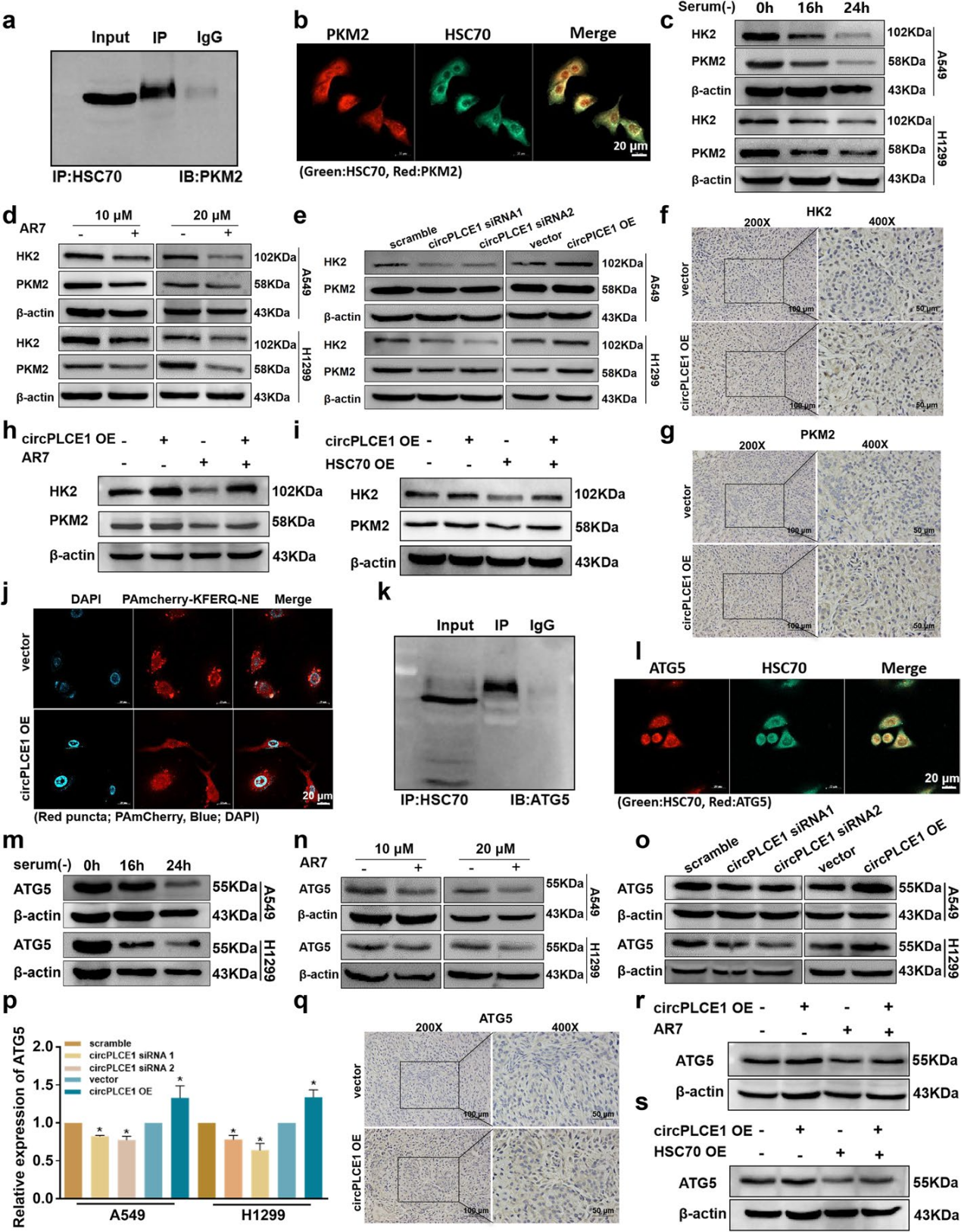
图6 circPLCE1通过CMA通路调控ATG5蛋白的表达
上述结果表明,circPLCE1通过抑制CMA导致ATG5表达增加。因此,作者进一步探究circPLCE1是否可以通过调控ATG5依赖的巨自噬来抑制肺癌进展。
流式检测、MDC染色和CYTO-ID染色结果显示,circPLCE1可正向调控巨自噬。Western blot分析A549细胞中ATG12和自噬标志物(P62和LC3B)的表达,发现circPLCE1正向调控ATG12蛋白和LC3B蛋白的表达,负向调控P62蛋白表达。
随后,通过免疫组化和Western blot分析裸鼠肿瘤中自噬标志物P62和LC3B的表达,结果显示,稳定过表达circPLCE1的裸鼠肿瘤中P62表达降低,而LC3B表达增加,验证了circPLCE1在体内外对巨自噬的促进作用。沉默ATG5则可抑制circPLCE1过表达对巨自噬的正向调控作用,表明circPLCE1通过ATG5依赖的途径促进巨自噬。
为了进一步探究HSC70介导的CMA下调在肺癌进展中的作用,流式检测circPLCE1和HSC70同时过表达后细胞自噬水平的变化,发现HSC70过表达可逆转circPLCE1过表达引起的巨自噬增加,表明circPLCE1可通过靶向HSC70促进巨自噬。
随后,CCK-8实验、EdU细胞增殖和流式实验结果显示,HSC70过表达抑制了circPLCE1过表达引起的细胞活力下降、细胞增殖能力下降及细胞凋亡的增加。综上所述,可得出结论:circPLCE1能够靶向HSC70,抑制CMA活性,并通过CMA通路促进ATG5依赖的巨自噬,从而抑制肺癌进展。
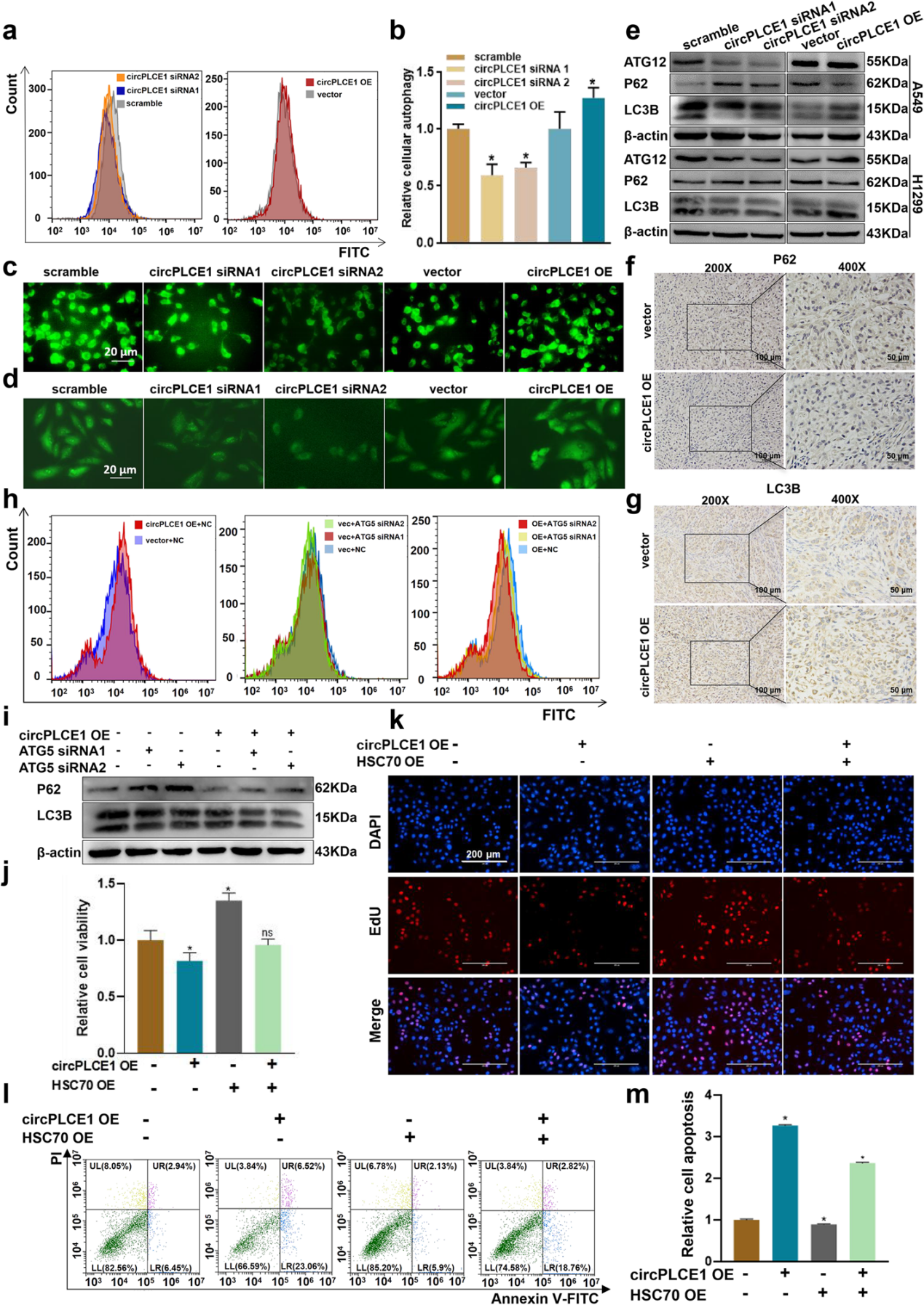
图7 circPLCE1通过靶向HSC70抑制肺癌进展,并通过CMA通路调节ATG5依赖的巨自噬
研究结论
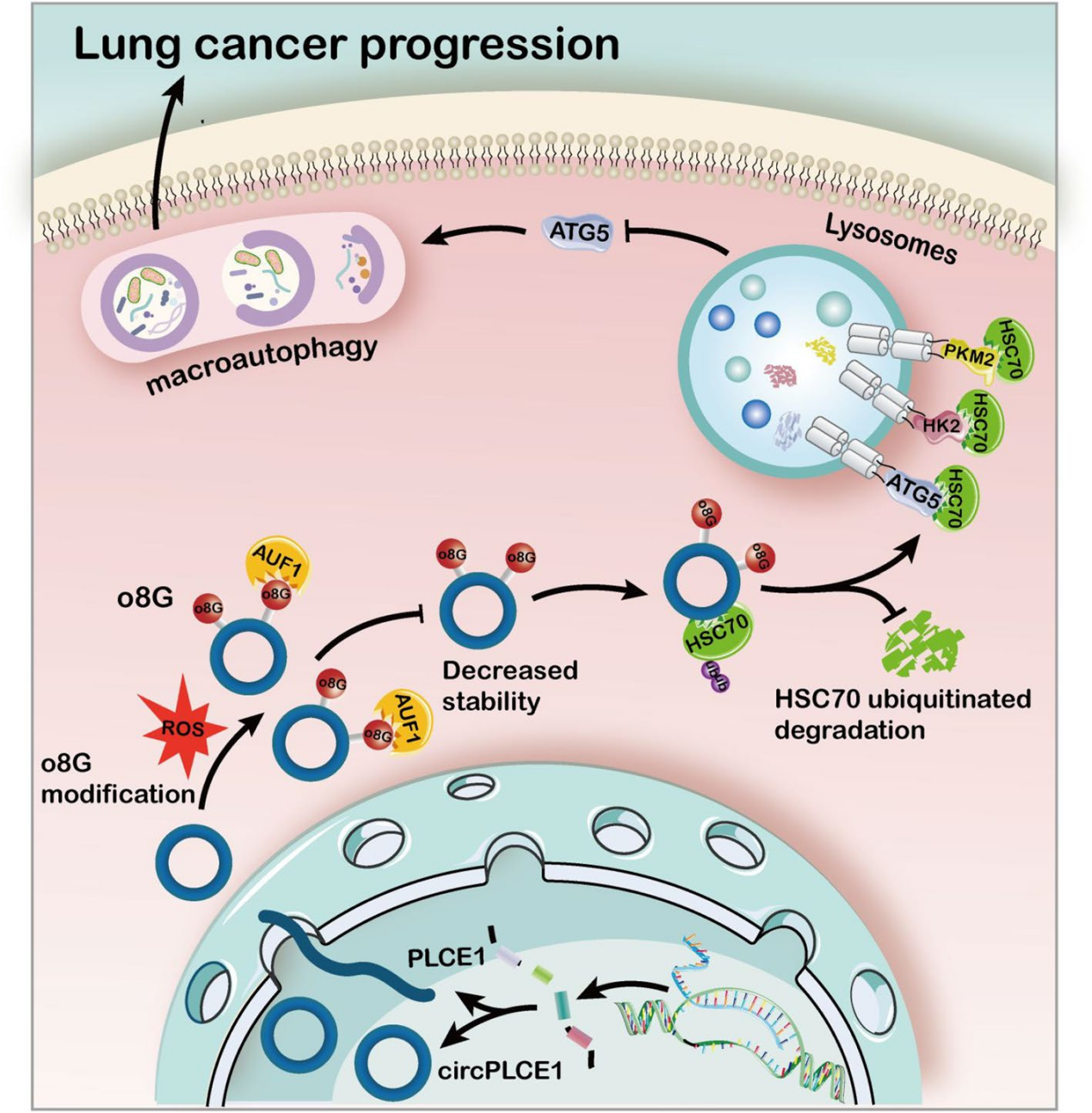
本研究揭示了环状RNAs上存在o8G修饰,以及o8G修饰的环状RNAs在肺癌进展中的重要作用。AUF1能够作为特异性识别circPLCE1的ROS介导o8G修饰的‘reader’,进而调控其稳定性并促进其降解。
作者阐明了一种新的分子机制,通过circPLCE1靶向HSC70蛋白,提高其泛素化水平,抑制CMA活性,并通过CMA途径促进ATG5依赖的巨自噬,改变肿瘤细胞的命运,最终抑制肺癌的进展,为肺癌进展的分子机制以及肺癌治疗的潜在靶点提供了新的见解。
吉满生物
如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。欢迎访问吉满生物官网:
免费咨询电话:400-627-9288














