文献解析
糖尿病(DM)患病率在世界范围内迅速上升,心血管并发症是糖尿病患者死亡的主要原因,研究发现糖尿病心血管并发症的风险与高血糖暴露时间的长短密切相关,而线粒体自噬(Mitophagy)在高血糖介导的内皮损伤中发挥重要作用。但线粒体自噬在糖尿病血管损伤中的作用机制尚不清楚。
因此,阐明持续高糖暴露情况下线粒体自噬的动态变化及分子机制,对于深入理解糖尿病血管并发症的发生发展具有重要意义。
文献来源
中国药科大学科研团队在期刊《Advanced Science》上发表题为“Syntaxin 17 Translocation Mediated Mitophagy Switching Drives Hyperglycemia-Induced Vascular Injury”
研究采用了糖尿病ApoE-/-小鼠及人脐静脉内皮细胞(HUVEC)模型,系统地分析了不同时程高糖暴露对线粒体自噬通路的调控以及血管损伤的发展过程。
项目研究
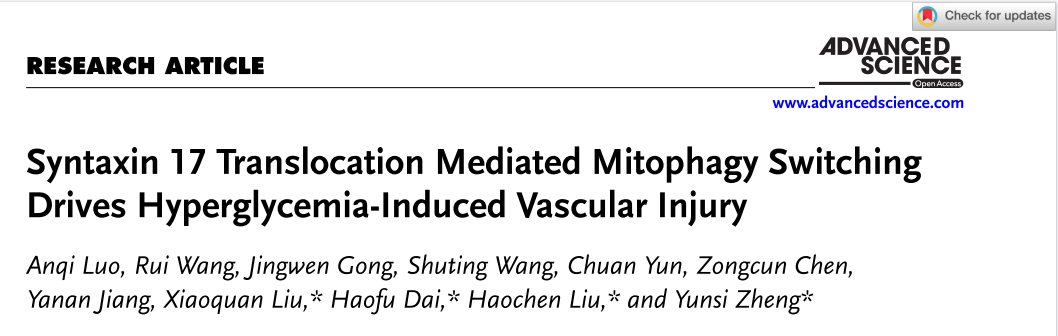
为了全面了解高血糖导致的血管损伤机制,研究构建了糖尿病ApoE-/-小鼠模型,检测不同时间点(0周、6周、20周高血糖)小鼠主动脉的表达变化。结果显示在高糖6周和20周条件下,主动脉组织中与线粒体自噬相关的蛋白表达显著上调,并且这种线粒体自噬的增强早于血管内皮损伤。
使用人脐静脉内皮细胞(HUVECs)模型,12小时和72小时高糖作用,观察到线粒体自噬激活,并随着高糖暴露的延长,主动脉粥样硬化面积、巨噬细胞和血管平滑肌细胞比例、内皮凋亡、以及氧化应激标志物皆显著升高。然而短时高糖处理(12h)并未诱导明显凋亡或氧化应激,也就是表明线粒体自噬的激活要早于高糖诱导的内皮损伤。
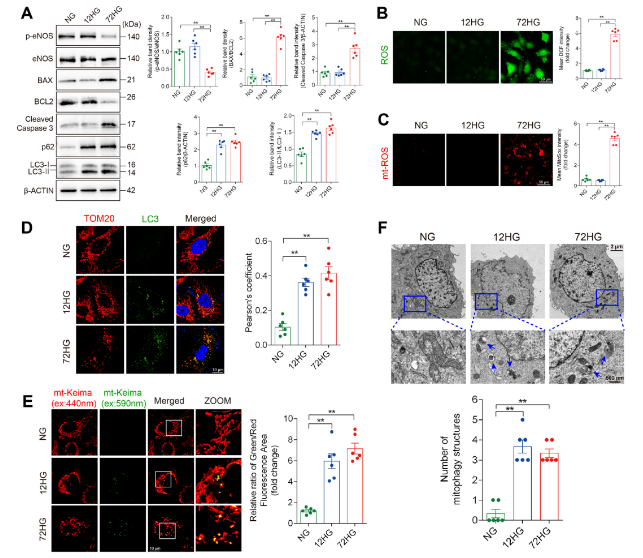
图1 线粒体自噬激活先于高血糖诱导的血管内皮损伤(HUVEC模型)
Parkin介导的线粒体自噬被认为是主要的线粒体自噬机制。短时高糖(12h)激活了Parkin依赖性线粒体自噬,功能实验证实敲低Parkin会加重高糖诱导的内皮细胞氧化应激和凋亡,降低eNOS磷酸化,提示Parkin介导的自噬对抗高糖损伤具保护作用。

图2 短期高糖激活Parkin依赖性线粒体自噬
长期高糖(72h)则抑制Parkin途径,细胞观察长期高糖下线粒体分裂少,线粒体大部分被溶酶体包裹并降解。
蛋白质组和细胞亚分组结果提示,长期高糖会显著降低了Fis1(线粒体分裂相关蛋白)表达,并诱导STX17从内质网(ER)转位至线粒体,与LC3共定位,驱动Parkin非依赖的自噬通路途径。抑制STX17后,细胞的线粒体碎片化及丢失明显减轻,线粒体蛋白总量恢复,凋亡水平下降,eNOS活性上升,ROS生成减少。进一步实验证明,长期高糖下,STX17介导的自噬确实成为主要活跃通路,调控其表达可抵消高糖的部分有害后果。
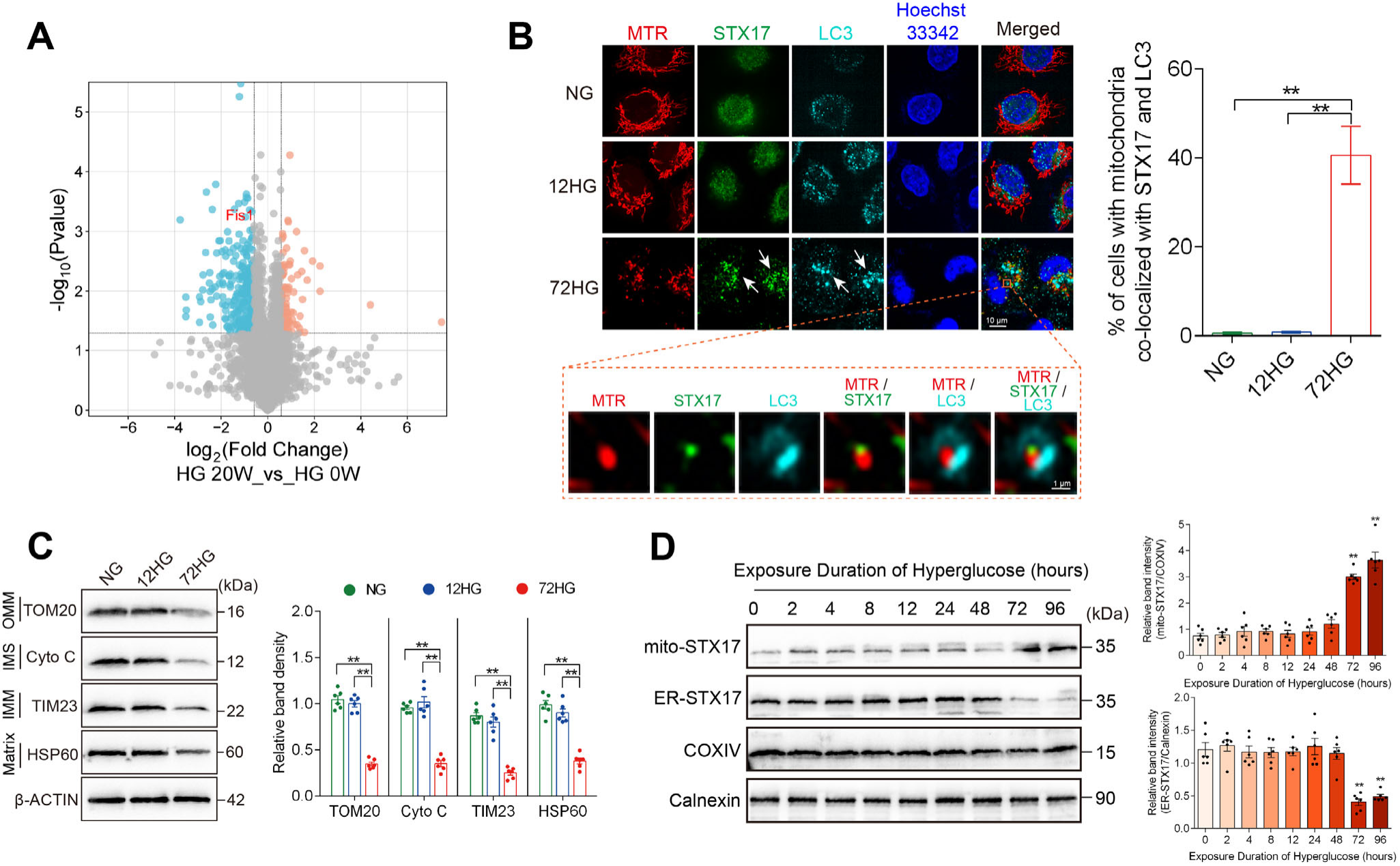
图3 长期高糖暴露启动STX17介导的线粒体自噬
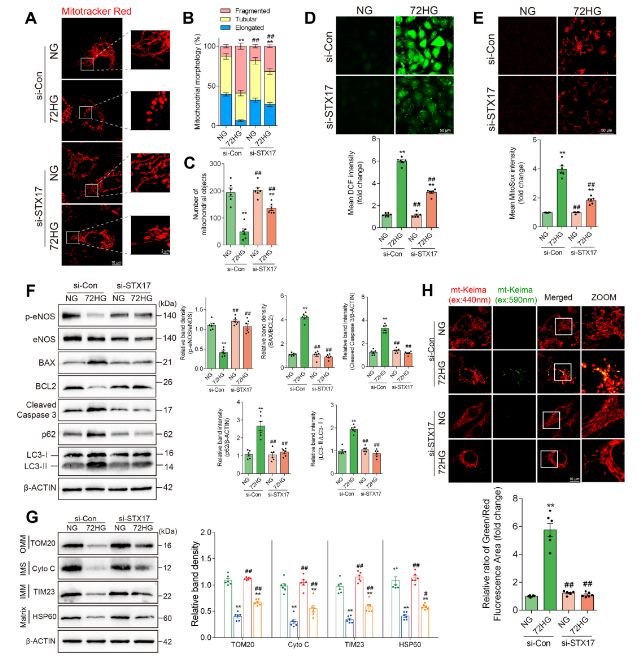
图4 沉默STX17可缓解高糖诱导的血管内皮损伤
高糖暴露下,Fis1表达呈先升后降趋势。
短期高糖显著上调Fis1表达,促进其与TBC1D15结合并维护Parkin依赖性自噬;长期高糖则降低Fis1表达,削弱该结合,并促使STX17与线粒体结合,完成自噬模式的切换。
过表达Fis1可阻止高糖诱导的自噬通路切换,敲低Fis1则促进了STX17介导自噬的提前激活和细胞损伤加重。
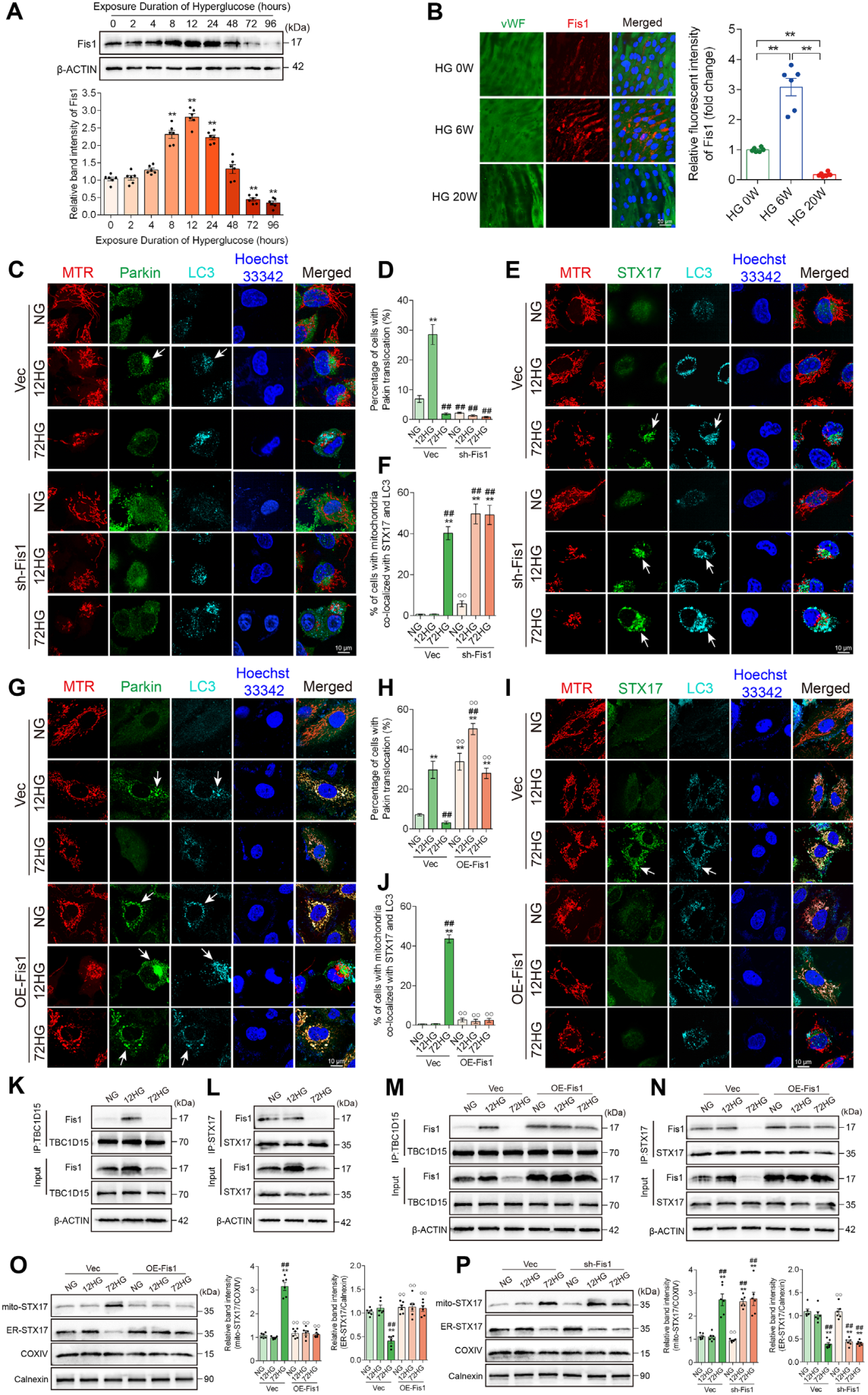
图5 Fis1参与Parkin-与STX17-介导自噬通路的切换
长期高糖下,Fis1过表达能逆转线粒体蛋白丢失和碎片化,还可明显降低ROS和线粒体ROS,减少细胞凋亡,提高eNOS磷酸化,改善内皮细胞功能。这提示增强Fis1有助于维持线粒体自噬平衡、减轻长时高糖损伤。
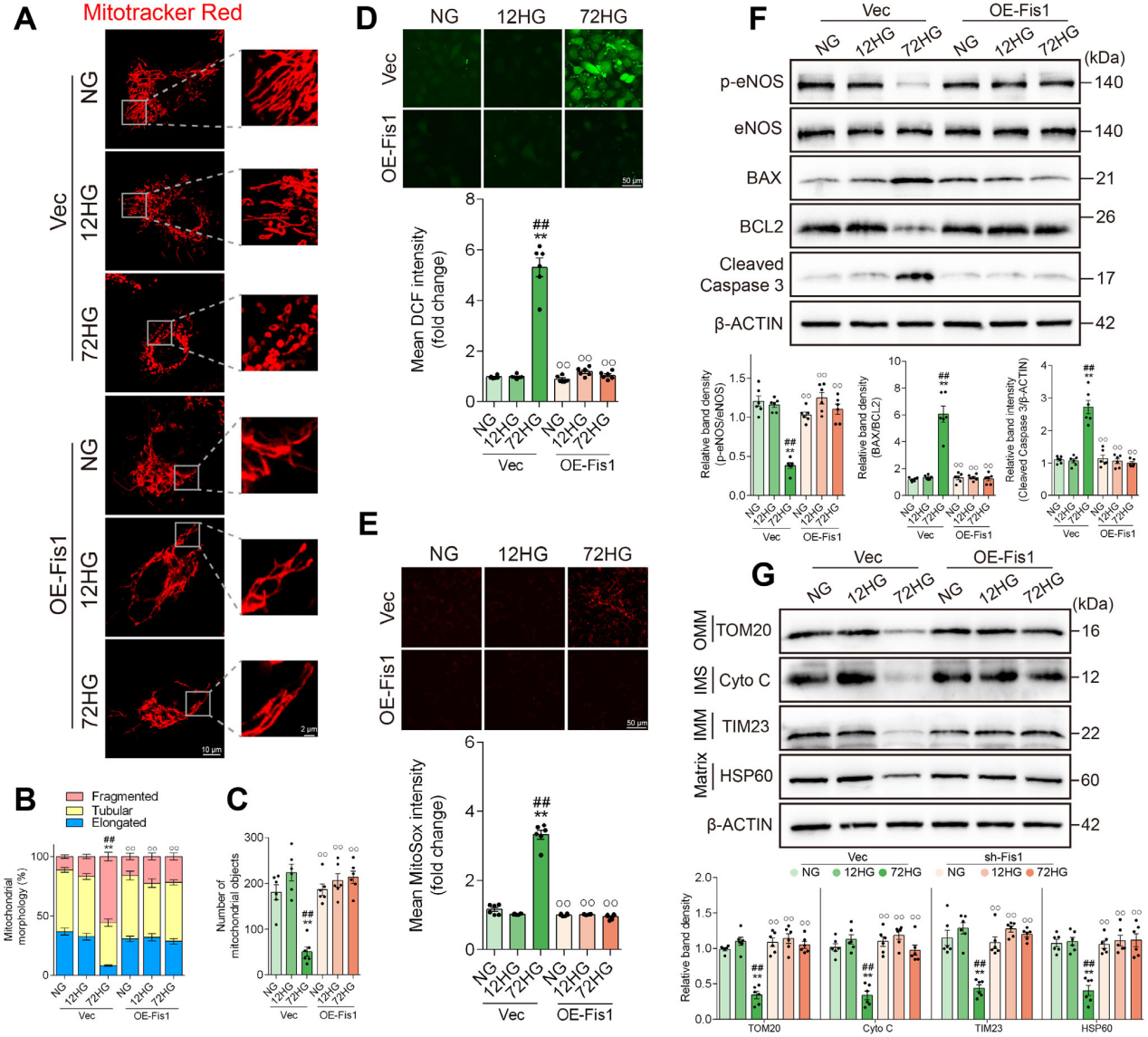
图6 Fis1过表达可缓解高糖引起的血管内皮损伤
体内实验用AAV9敲低小鼠主动脉内皮细胞中的Fis1后发现,这类小鼠在高糖条件下主动脉粥样硬化斑块更严重,炎症(巨噬细胞及平滑肌细胞浸润)及细胞凋亡水平均显著升高。与体外结果一致,Fis1缺失会加重氧化应激、细胞死亡和损伤。相关的线粒体蛋白水平也同样进一步下降,支持Fis1在高糖血管损伤中的关键保护作用。
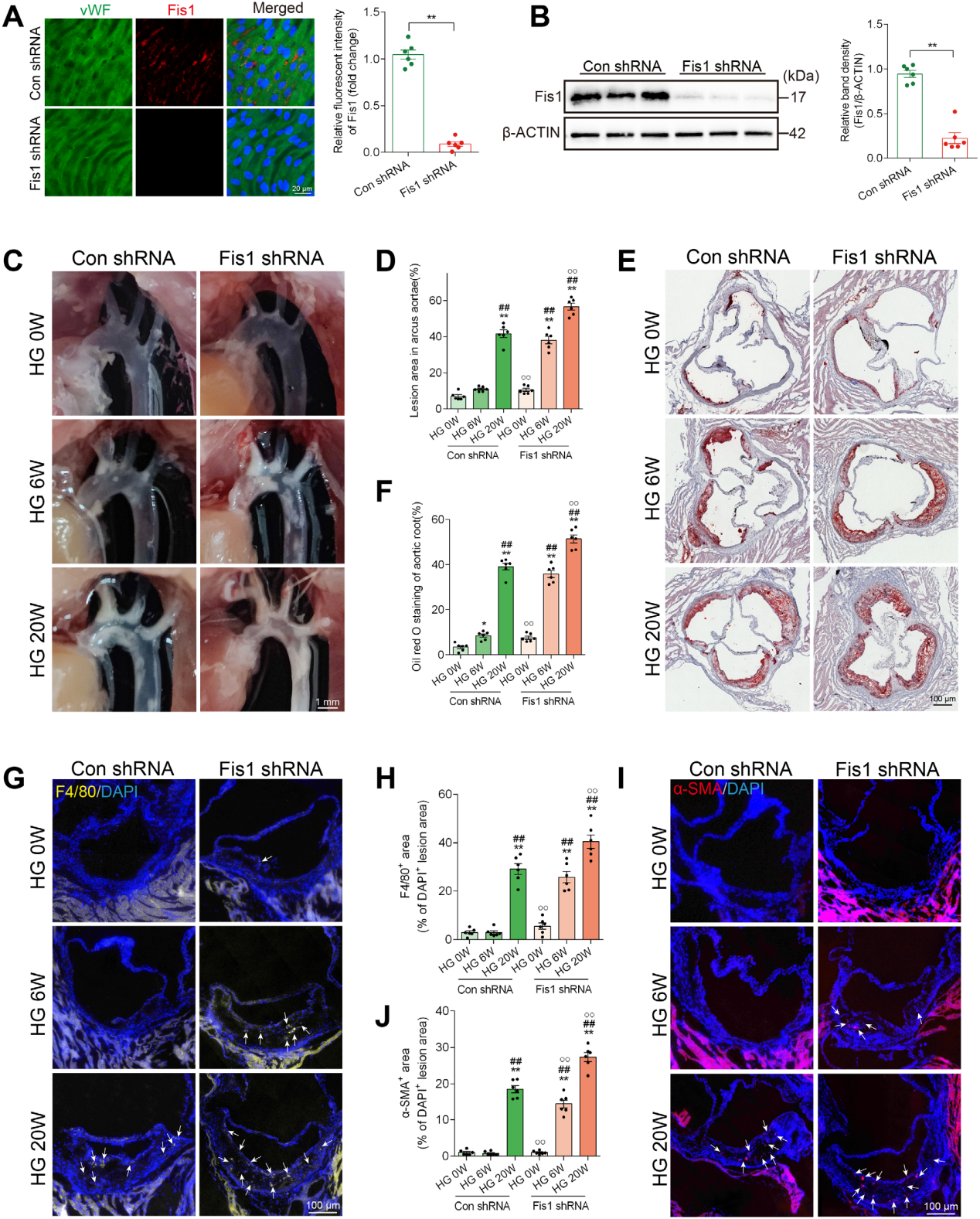
图7 内皮特异性沉默Fis1加剧高糖诱导的血管内皮损伤
研究结论
本研究从细胞和动物水平系统性揭示了高血糖状态下从Parkin介导到STX17介导的线粒体自噬转换会驱动血管内皮损伤,为糖尿病心血管并发症的治疗策略提供了有价值的观点。在糖尿病患者高糖诱导的血管损伤中,线粒体自噬开关可能是疾病进展的新指标。
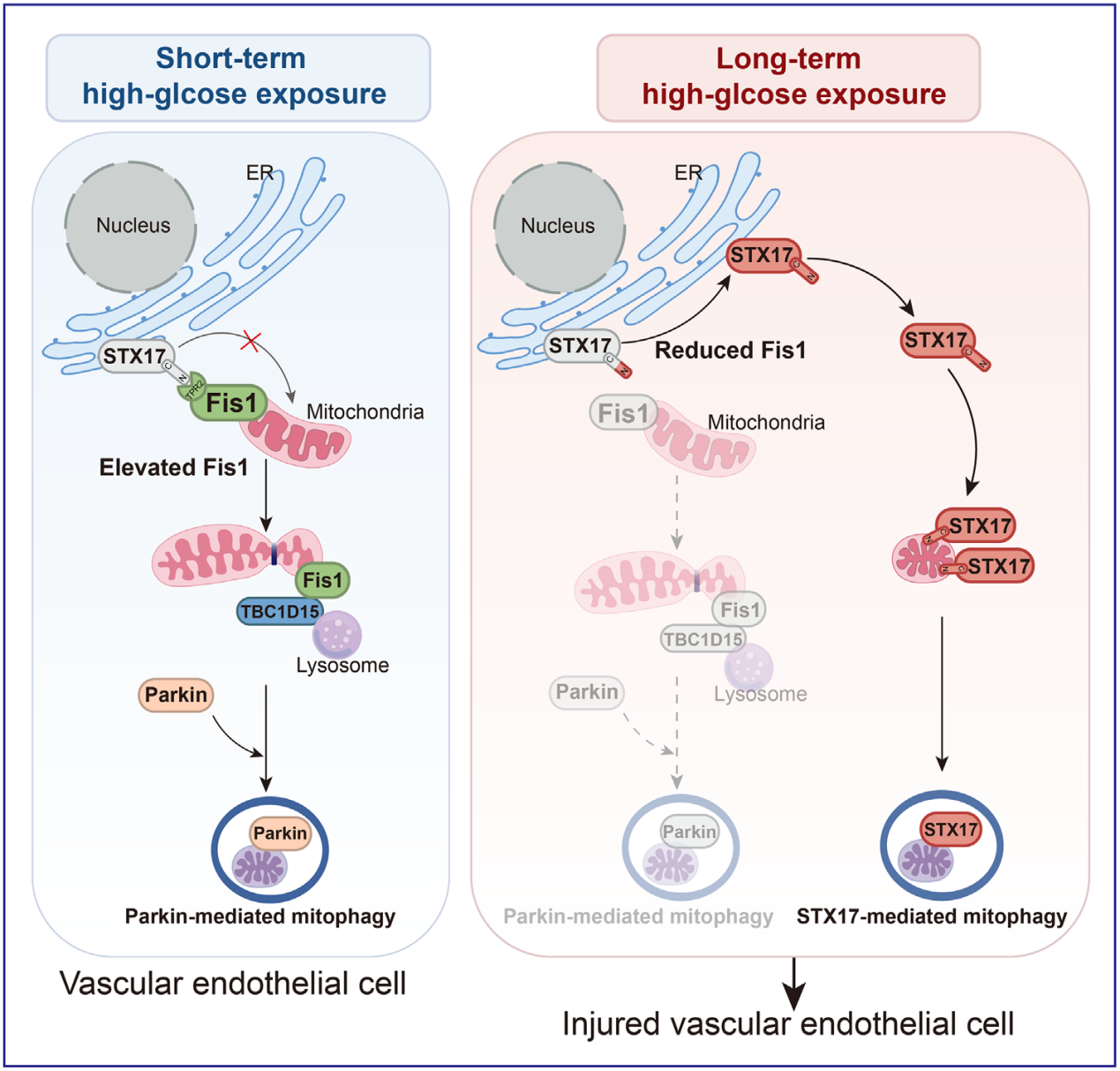
图8 血管内皮细胞在短期和长期高糖暴露后激活的不同线粒体自噬途径
吉满助力
本研究中所用的AAV9-Tie2-Mouse_Fis1-shRNA和对照AAV均由吉满生物(Genomeditech)提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
原文引用
“Genomeditech Biotechnology (Shanghai, China) constructed the adenoviruses. To specifically knock down Fis1 protein expression in the endothelium of ApoE−/− mice, adeno-associated virus serotype 9(AAV9) carrying Fis1 shRNA driven by the endothelial-specific Tie2 promoter was used. The Fis1 shRNA targeting sequence was 5′-CCTGATTGATAAGGCCATGAA-3′, and the control shRNA sequence was 5′-TTCTCCGAACGTGTCACGT-3′. Mice were injected via the tail vein with recombinant adeno-associated virus 9 (AAV9) containing Fis1 shRNA (1.5× 1011 vector genomes per mouse) under the supervision of the Tie2 promoter. ”
文献原文
https://pubmed.ncbi.nlm.nih.gov/40135829/
声明:此推文仅代表作者个人观点,如有不科学之处,联系小编敬请指正!