5 月 14 日,CDE 官网公示,强生达雷妥尤单抗注射液(皮下注射)新适应症上市申请正式获受理。此次申报预计适应症为:联合硼替佐米、来那度胺和地塞米松(VRd)治疗新诊断、适合进行造血干细胞移植的多发性骨髓瘤(MM)患者。点击了解VEGF靶点相关产品
图源:CDE 官网
Darzalex Faspro由杨森和Genmab联合开发,是首款可以通过皮下注射给药的抗CD38抗体,将患者接受治疗的时间从几个小时缩短到几分钟。除了获得FDA批准治疗多发性骨髓瘤以外,它还获得批准治疗免疫球蛋白轻链淀粉样变性。
达雷妥尤单抗是全球首款获批的 CD38 单抗,2015 年 11 月在美国 FDA 首次获批上市,用于联合来那度胺/硼替佐米和地塞米松治疗既往接受过治疗的多发性骨髓瘤患者。2019 年 7 月,达雷妥尤单抗以附条件方式首次在中国上市,用于治疗复发或难治性 MM。
近年来,这款抗体药物已成为强生在肿瘤领域的“明星产品”之一,2024 年全球销售额达 116.7 亿美元,同比增长 19.77%,首次突破百亿美元大关,显示出强劲的市场潜力。
为了提升用药便利性和患者依从性,强生开发了皮下注射剂型(与重组人透明质酸酶 PH20 联合固定剂量注射),该剂型最早于 2020 年在美国获批,目前在全球范围内已有 8 项适应症获批,在中国也已批准用于 7 项治疗场景。
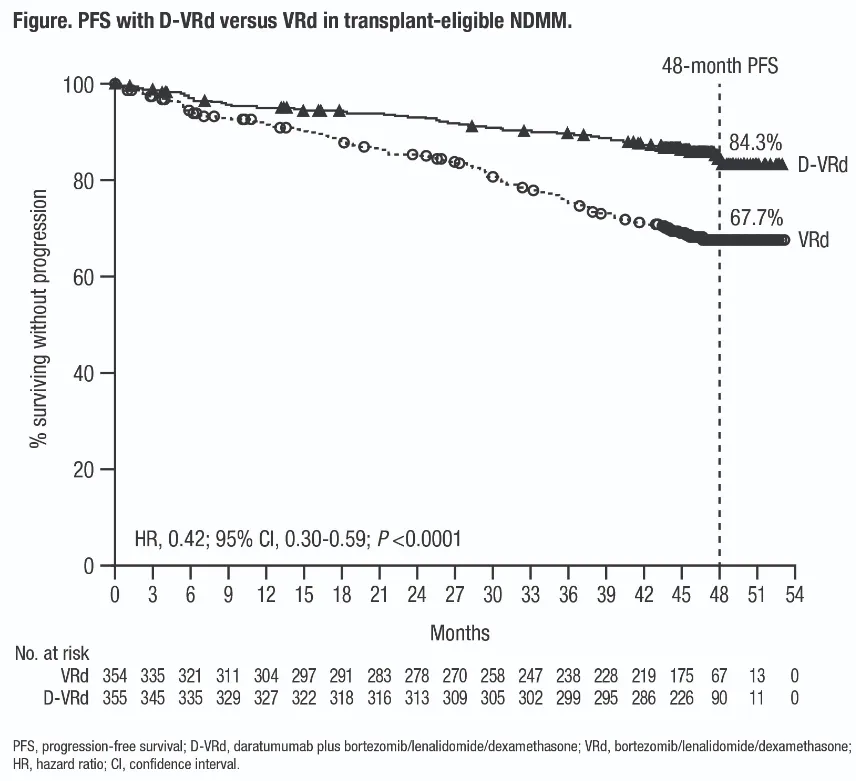
此次申报所依据的关键数据来自III期PERSEUS研究,该研究对比了 D-VRd(达雷妥尤单抗+VRd)和 VRd 联合方案在新诊断、可移植 MM 患者中的疗效。研究共纳入 709 名患者,D-VRd 组在多项核心疗效指标上均显著优于对照组:
无进展生存期(PFS)显著提升:HR 为 0.42,48 个月 PFS 率达 84.3%(VRd 组为 67.7%)
完全缓解率(CR):87.9% vs 70.1%(P < 0.0001)
最小残留病灶阴性率(MRD):75.2% vs 47.5%(P < 0.0001)
虽然两组均未达到中位 PFS,但 D-VRd 组在长期疾病控制方面优势显著。总体生存(OS)数据尚未成熟。
PERSEUS试验的PFS分析结果
在安全性方面,D-VRd 组与 VRd 组的不良事件发生谱基本一致。尽管 D-VRd 组严重不良事件(TEAE)略高于对照组(57.0% vs 49.3%),但因不良事件导致治疗中断的比例却显著降低(8.8% vs 21.3%),显示其在可控性与疗效间达成良好平衡。