第48届圣安东尼奥乳腺癌研讨会(SABCS)将于2025年12月9日至12日在美国圣安东尼奥举行。
宜联生物研发的HER3 ADC药物YL202/BNT326将在会上首次公布HR+且HER2阴性或低表达乳腺癌的临床数据。该研究聚焦于既往多线治疗失败的HR+、HER2阴性或低表达乳腺癌患者,展现了令人鼓舞的疗效与良好的安全性。点击了解HER3相关产品
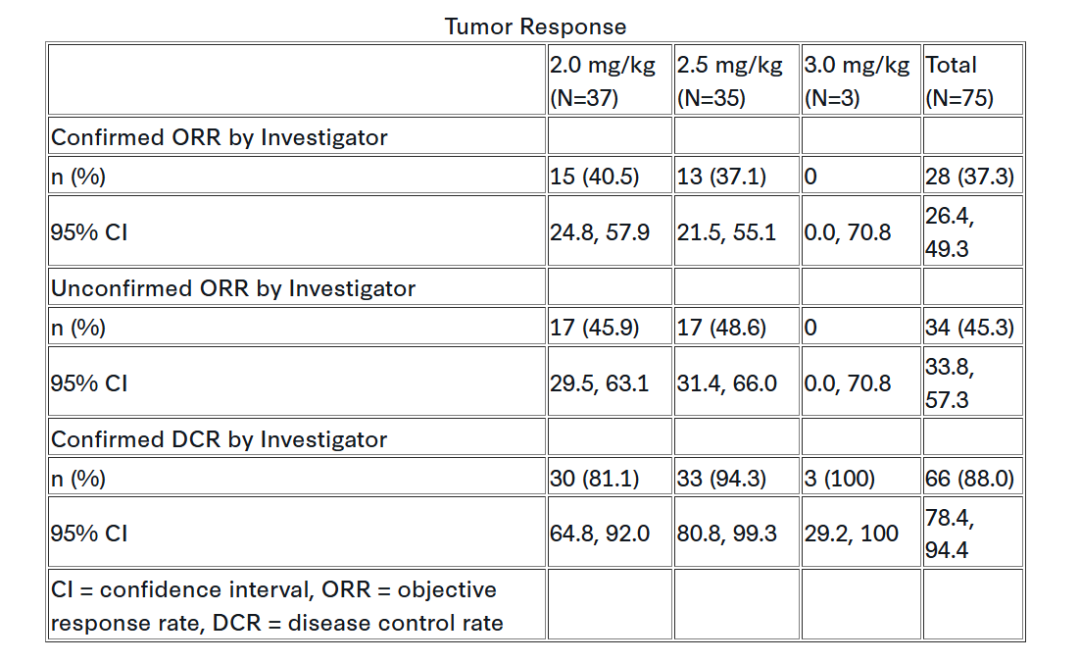
这项在中国开展的II期临床(NCT06439771)旨在评估YL202/BNT326单药治疗局部晚期或转移性乳腺癌患者的疗效。纳入对象为:既往接受≥1种CDK4/6抑制剂、内分泌治疗,以及0-4线化疗的HR+且HER2阴性(HER2无表达或HER2超低表达 [0 < IHC < 1+])和HER2低表达(IHC 1+ 或 2+/ISH-)患者。试验采用每3周一次(Q3W)2.0、2.5或3.0 mg/kg剂量给药。
主要终点为研究者评估的客观缓解率(ORR)和推荐剂量;次要终点包括安全性、疾病控制率(DCR)、缓解持续时间、无进展生存期(PFS)及总生存期(OS)。
截至2025年9月1日,共75例患者接受YL202/BNT326治疗,其中49例仍在治疗。患者中位年龄55.5岁,均为亚裔,大多数ECOG PS评分为1(73.3%)。
根据当地检测结果,46例为HER2低表达,29例为HER2阴性。中位随访5.5个月后,总体ORR达到37.3%。更完整的数据将在会议上公布。
整体安全性可控。71例(94.7%)患者出现治疗期间不良事件,其中70例(93.3%)为治疗相关不良事件(TRAE),14例(18.7%)为≥3级。剂量调整至2.0-3.0 mg/kg后,安全性明显改善。11例(14.7%)因TRAE减量,未出现因TRAE导致停药或死亡。最常见的TRAE包括白细胞计数下降(57.3%)、贫血(52%)、中性粒细胞计数下降(50.7%)和恶心(34.7%)。3级及以上TRAE发生率较低,其中以中性粒细胞计数下降(8%)、贫血(5.3%)和白细胞计数下降(4%)最显著。
数据表明,YL202/BNT326在HR+且HER2阴性/低表达乳腺癌患者中展现了令人鼓舞的疗效,并且安全性可控。
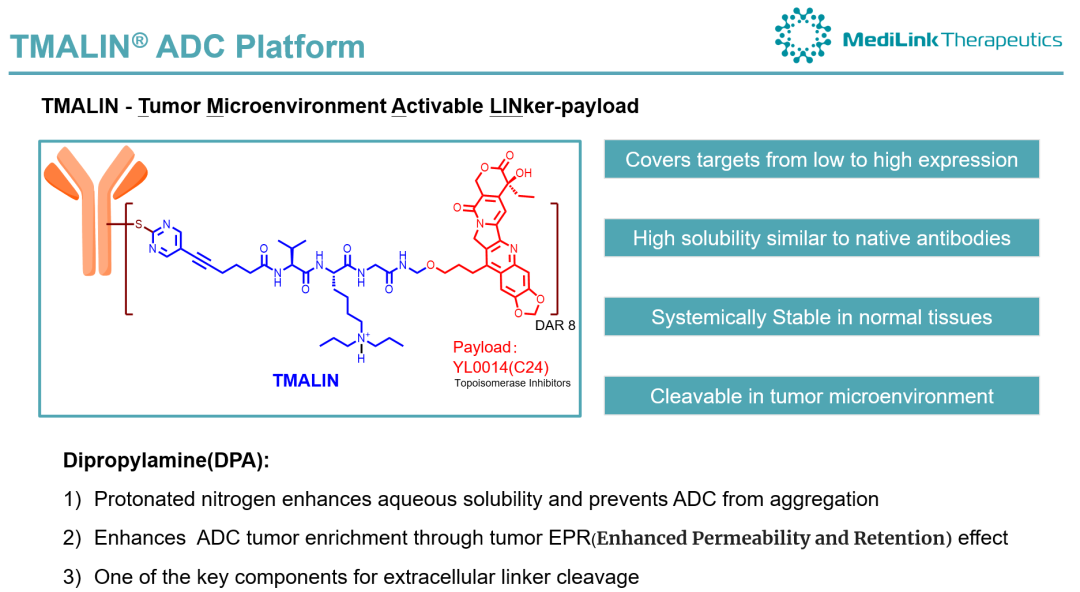
YL202/BNT326基于宜联生物TMALIN®平台开发。此外,YL202/BNT326还正在与PD-L1/VEGF双抗Pumitamig联合用于乳腺癌患者的评估(NCT07070232)。
总结
过去一年,HER3 ADC药物的研发并非一帆风顺。此前,第一三共和默沙东合作开发的HER3 ADC已全面转向HR+/HER2-乳腺癌治疗领域;宜联的YL202/BNT326在经历FDA临床暂停并获解禁后,研发策略更趋谨慎。目前,YL202已启动第二项II期注册性临床试验。