文献解读
最新发表在国际顶尖学术期刊《Cell》上题为“Unraveling mitochondrial influence on mammalian pluripotency via enforced mitophagy” 的研究论文。
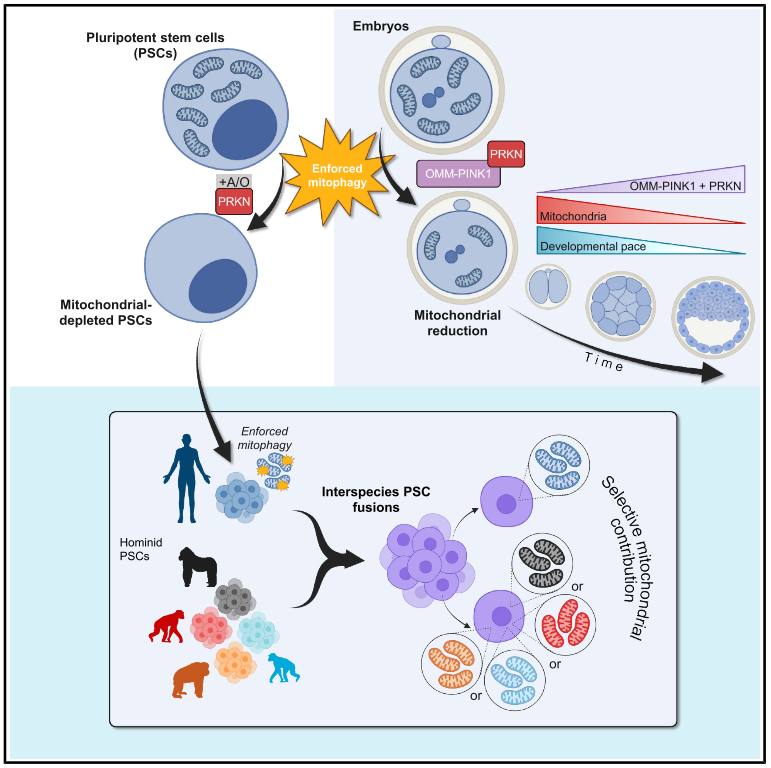
通过构建“强制线粒体自噬”工具,实现了在体外对多能干细胞(PSC)线粒体的近乎完全清除,并将该策略扩展到体内早期胚胎。团队据此建立“同核不同线粒体”的人-猿复合PSC模型,定量解析线粒体基因组差异对多能态与代谢的细微影响;并在小鼠胚胎中界定了着床前发育对线粒体丰度的阈值依赖。
研究背景
哺乳动物多能性状态(如胚胎干细胞)具有高度自我更新和分化潜能的特征,在胚胎发育和再生医学领域具有重要价值。虽然多能性的维持和丧失一直被广泛研究,但调控其转换的分子机制尚未完全阐明。
大量证据表明,细胞代谢状态,尤其是线粒体的数量、功能和活性与多能性状态密切相关。其中,线粒体自噬作为一种选择性降解损伤或过剩线粒体的自噬过程,在维持线粒体质量和细胞代谢稳态方面发挥着关键作用。其在多能干细胞中的功能与机制有待研究。
项目研究
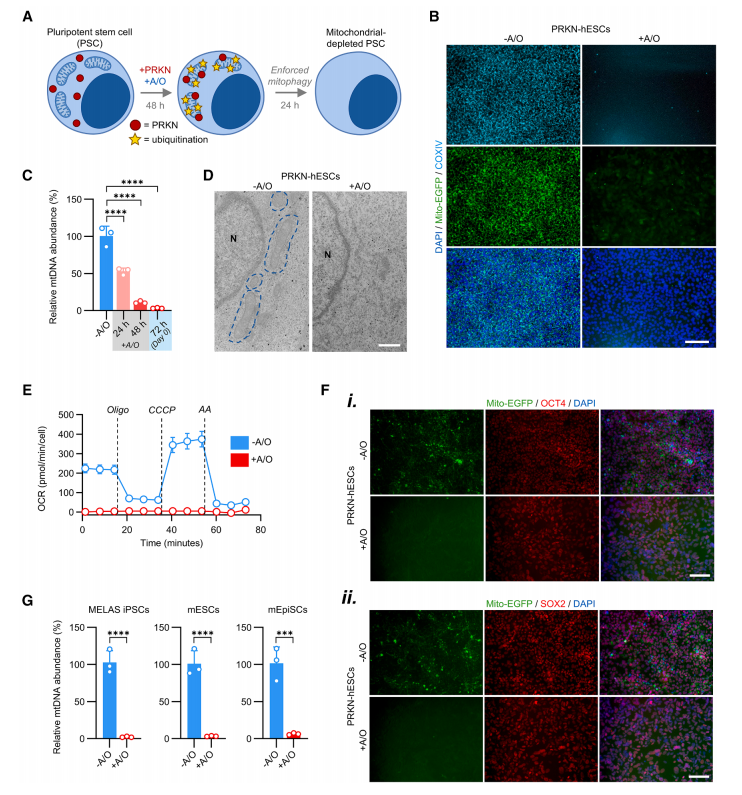
为清除多能干细胞中的线粒体,作者在hESC(H9)中稳定表达 mCherry-PRKN(Parkin)与线粒体定位的 Mito-EGFP,构建 PRKN-hESCs;用寡霉素A+抗霉素A(A/O)去极化线粒体膜,触发 PINK1–PRKN 介导的广泛线粒体自噬,实现近乎“无线粒体”的可重复模型。
去线粒体后会引发生存与分裂停滞,短期可维持多能表型。提示线粒体对多能稳定性至关重要。
Fig.1 强制线粒体自噬产生清除线粒体的多能干细胞
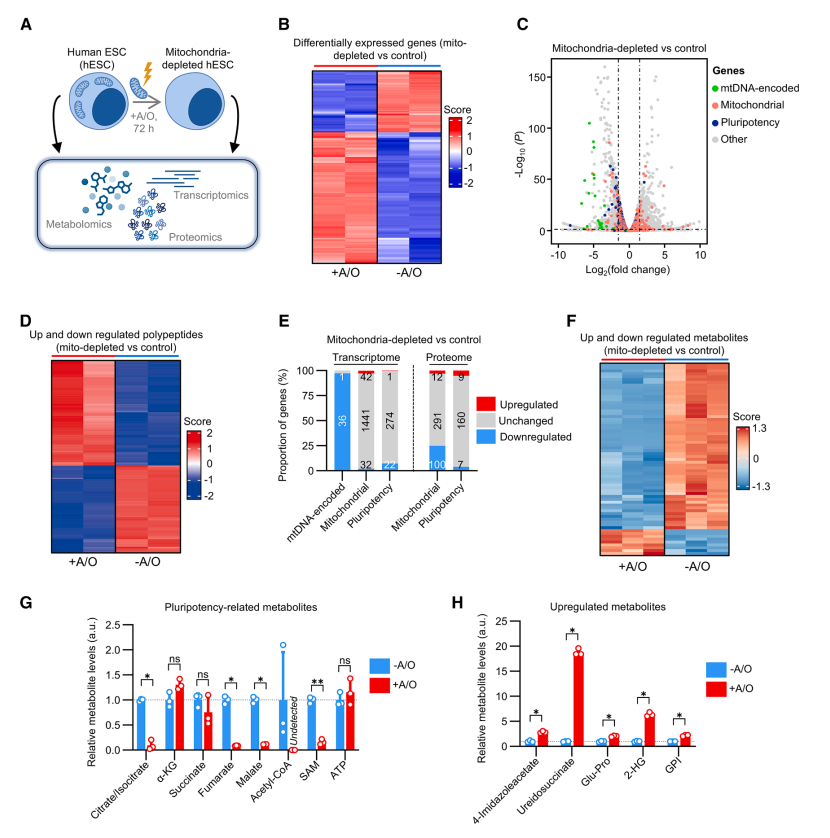
多组学分析显示,清除线粒体后大多数多能蛋白(~91%)和核编码线粒体蛋白(~72%)丰度不变,但mtDNA 编码基因几乎全部下调。
代谢组学分析由线粒体代谢产生的多种底物(SAM、Ac-CoA)严重缺失,TCA循环关键中间产物明显下降,部分糖酵解相关代谢产物上升。揭示代谢紊乱先于多能性因子的丢失,进一步说明线粒体-代谢轴的失衡最终破坏多能稳态。
Fig.2 线粒体缺失对人胚胎干细胞影响的多组学分析
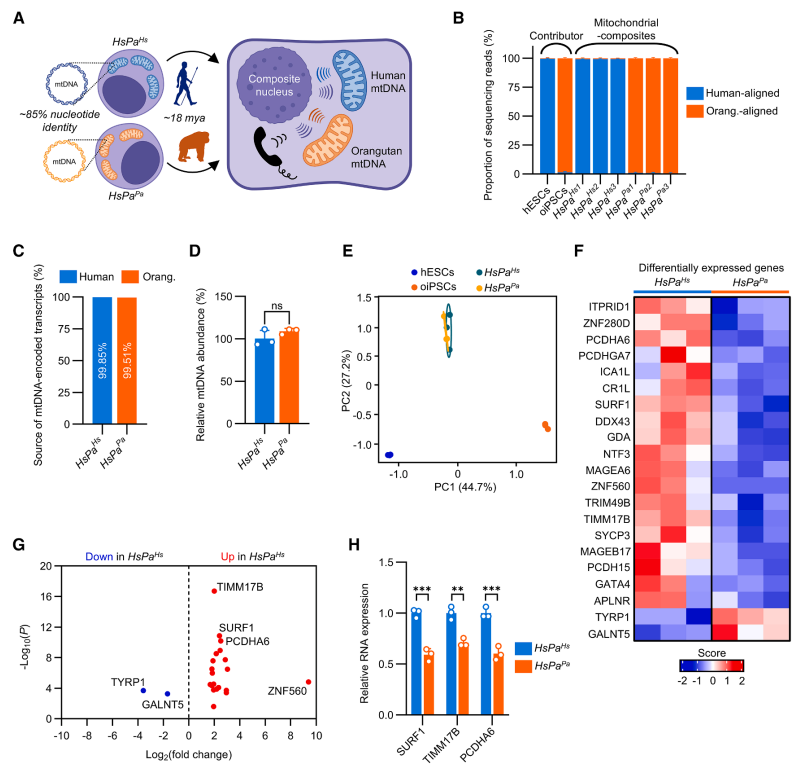
通过人类 hESC 与各类人猿 iPSC(黑猩猩/倭黑猩猩/大猩猩/红毛猩猩)融合,成功获得了四倍体复合 PSC。结果发现,这些复合细胞复合 PSC 会选择性去除非人人科动物的线粒体基因组,只保留人类的线粒体基因组。
使用强制线粒体自噬技术,预去线粒体打破选择偏好,再与 NHH iPSC 融合,可建立仅 mtDNA 不同、核背景相同的线粒体复合PSC 。进一步比较发现,不同mtDNA来源的嵌合细胞,其多能性和整体基因表达基本一致,仅在能量代谢和线粒体功能相关的分子水平出现细微差异。也就是说,跨物种mtDNA交换不会破坏多能性,但能微调细胞代谢特征。
Fig.3 人类-猩猩复合PSCs揭示了线粒体基因组的功能重叠和分化
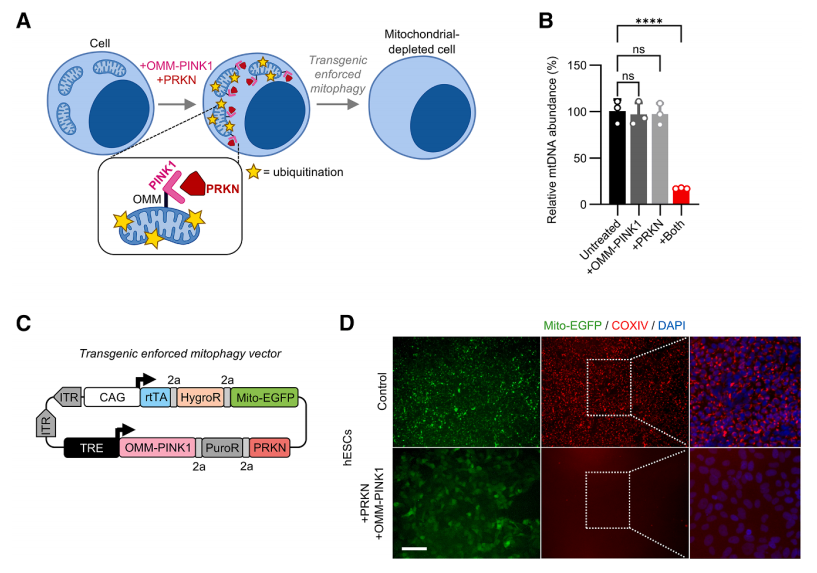
最后,作者开发了线粒体外膜靶向PINK1/PRKN过表达体系,体内mRNA注射后可有效降低受精卵及早期胚胎线粒体及mtDNA含量。
研究发现,当胚胎线粒体数量降至低于阈值时(<65%),早期胚胎发育受阻,而中度下降(65-80%)可恢复且最终发育为健康个体。这一结果揭示胚胎发育窗口期内,线粒体含量的精密调控对于多能维持与发育“可逆阻断”具有决定性作用。
Fig.4 转基因OMMPINK1和PRKN的过表达加强了线粒体自噬
Fig.5 强制线粒体自噬有效清除了多能干细胞和胚胎的线粒体
研究结论
本研究表明,通过强制线粒体自噬可在多能干细胞(PSCs)中实现高效线粒体清除;进一步构建的人—猿跨物种复合PSCs显示对线粒体DNA(mtDNA)来源具有选择性,并在仅更换物种特异的mtDNA时呈现细微但一致的表型差异(转录与代谢层面)。
此外,采用降低线粒体丰度的策略可减缓小鼠着床前胚胎发育进程。整体上,该工作提供了可编程操控线粒体丰度与基因组来源的工具,揭示了其对多能性和早期发育的关键影响。
吉满生物
如想了解更多质粒构建、病毒包装、稳转株构建、敲除细胞株、报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288