文献解析
小胶质细胞活化是阿尔茨海默病(AD)早期事件,不仅在Aβ斑块形成前发生,其异常增生和功能障碍会加重淀粉样病理,并通过炎症反应导致神经损伤,同时多种阿尔茨海默病易感基因在小胶质细胞中高度表达,提示其在疾病发生发展中具有重要作用,但具体的细胞机制尚未明了。
环状RNA(circRNA)是一类在脑组织富集且功能多样的内源性非编码RNA,因其稳定性和特异性备受关注,并被发现与阿尔茨海默病(AD)严重程度密切相关。尽管已有研究揭示circRNA在AD患者和模型中表达失调,且神经元和部分非神经元细胞中的circRNA谱系被报道,但小胶质细胞中circRNA的表达特征及其在AD相关神经炎症中的作用尚不明确,因此系统研究小胶质细胞circRNA的表达谱及功能将为理解AD的发病机制带来新见解。
文献来源

今年2月,上海交通大学医学院基础医学院王昊教授团队在《Theranostics》期刊上发表题为“Microglial circDlg1 modulates neuroinflammation by blocking PDE4B ubiquitination-dependent degradation associated with Alzheimer’s disease” 的研究性论文。
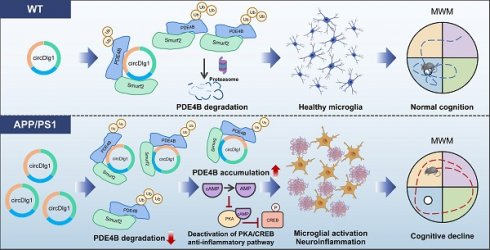
研究首次揭示小胶质细胞上调的circDlg1可调控AD相关小胶质细胞应答,其介导的PDE4B翻译后调控新机制为开发靶向小胶质细胞应答的AD治疗策略提供了新思路。
项目研究
为探究circRNAs在AD小胶质细胞中的作用,作者采用CD11b抗体磁珠分选法(MACS),从6月龄雄性野生型(WT)和APP/PS1(AD模型)小鼠皮层中分离小胶质细胞。
通过circRNA微阵列分析及多步筛选流程,在除线粒体染色体外的所有染色体上共检测到13420个circRNAs,与WT小鼠相比,APP/PS1小鼠皮层小胶质细胞中存在218个差异表达circRNAs,包括146个上调circRNAs和72个下调circRNAs。
进一步筛选得到9个符合以下标准的circRNAs:
(1)收录于circBase数据库
(2)长度200~2000 bp
(3)Rybak-Wolf等报道的人鼠保守circRNA
RT验证结果表明,其中6个circRNAs在APP/PS1小鼠皮层小胶质细胞中表达显著改变,选取丰度分析中最高的3个circRNAs,在LPS刺激的小鼠BV-2小胶质细胞系中检测,结果显示,仅circDlg1表达上调。
AD小鼠组织水平RT检测分析,circDlg1在AD易损脑区皮层和海马中高表达;荧光原位杂交(FISH)结合免疫染色显示,circDlg1在APP/PS1小鼠皮层小胶质细胞中特异性上调,而在神经元和星形胶质细胞中无显著变化。此外,AD患者小胶质细胞中circDLG1表达也显著高于健康对照组。上述结果表明,circDlg1的表达量在AD小胶质细胞中特异性上调。
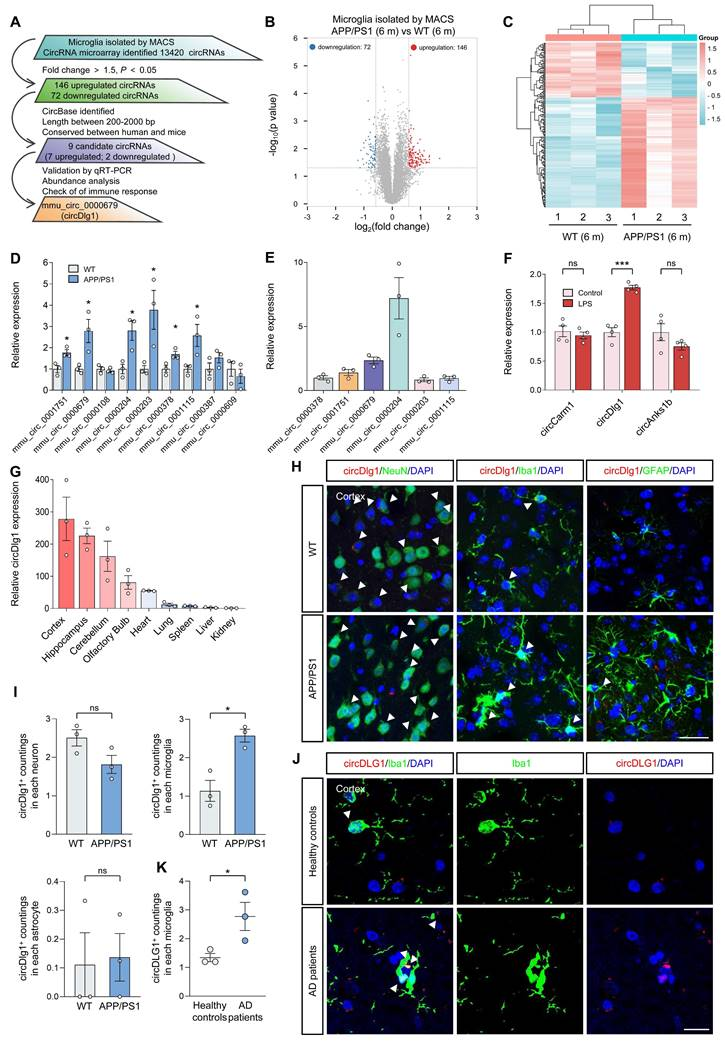
图1 CircDlg1在AD的小胶质细胞和LPS处理的BV-2细胞中特异性上调
研究表明,通过将促炎型M1小胶质细胞转化为抗炎型M2,可有效激活小胶质细胞在AD中的保护功能。
为此,作者探究了circDlg1对小胶质细胞极化的调控作用。在BV-2细胞中敲低circDlg1可显著上调M2标志物,Arg1和CD206;下调M1标志物,iNOS和CD86。LPS处理导致的M2标志物减少和M1标志物增加现象,可被circDlg1敲低有效逆转。进而说明circDlg1是小胶质细胞极化的关键调控开关,其下调可能激活小胶质细胞的保护性功能。
此外,小胶质细胞的淀粉样蛋白吞噬活性可直接影响Aβ斑块病理中的清除效率。为验证circDlg1是否调控小胶质细胞的Aβ摄取能力,作者通过流式细胞术进行体外实验。在BV-2细胞和原代小胶质细胞中,circDlg1敲低均显著促进Aβ42-FAM的摄取,免疫染色结果同样显示Aβ42-FAM吞噬显著增加。这些结果证实circDlg1在调控小胶质细胞Aβ吞噬活性中起重要作用。综上,circDlg1在AD病理中对小胶质细胞应答Aβ沉积具有关键调控作用。
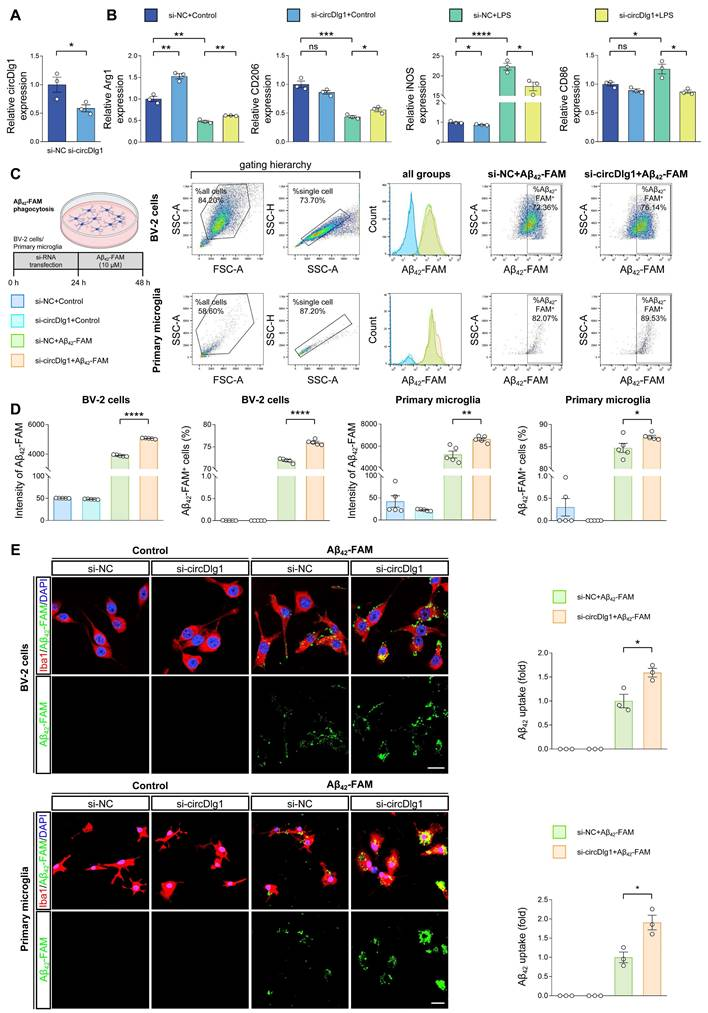
图2 circDlg1的敲除促进了小胶质细胞M2极化和体外淀粉样蛋白摄取
基于上述体外实验验证结果,作者后续进一步通过体内实验阐明circDlg1的分子机制。选用6月龄雄性WT和APP/PS1小鼠,侧脑室注射带有Iba1启动子(小胶质细胞特异性启动子)的AAV9腺相关病毒(Iba1-sh-circCon/Iba1-sh-circDlg1)。注射两个月后,取样检测。RT结果显示,与对照组相比,APP/PS1-Iba1-sh-circDlg1小鼠CD11b+小胶质细胞中circDlg1的表达显著降低,而CD11b-细胞无显著变化,且线性Dlg1的mRNA水平未受影响。
此外,circDlg1敲低使APP/PS1小鼠小胶质细胞呈现区域性激活差异:Aβ斑块30 μm范围内激活增强,而远端区域激活减弱。形态学分析显示,circDlg1敲低后小胶质细胞突起数量增加、长度延伸。通过定量Aβ斑块30 μm范围内小胶质细胞覆盖面积和数量,发现circDlg1下调显著促进小胶质细胞向斑块的募集与包裹。
RT结果显示,APP/PS1-Iba1-sh-circDlg1小鼠小胶质细胞中稳态标志基因Tmem119表达显著上调,而疾病相关小胶质细胞(DAM)特征基因(Trem2、Tyrobp、ApoE、LpI、AxI、Cst7、Clec7a)表达降低。同时,小胶质细胞、皮层及海马中促炎因子(IL-6、IL-1β、TNF-α)和胶质细胞激活标志物(Aif1、GFAP)表达均显著下降。上述结果证实,小胶质细胞特异性敲低circDlg1能有效增强其与Aβ斑块的相互作用,并改善APP/PS1小鼠的神经炎症状态。
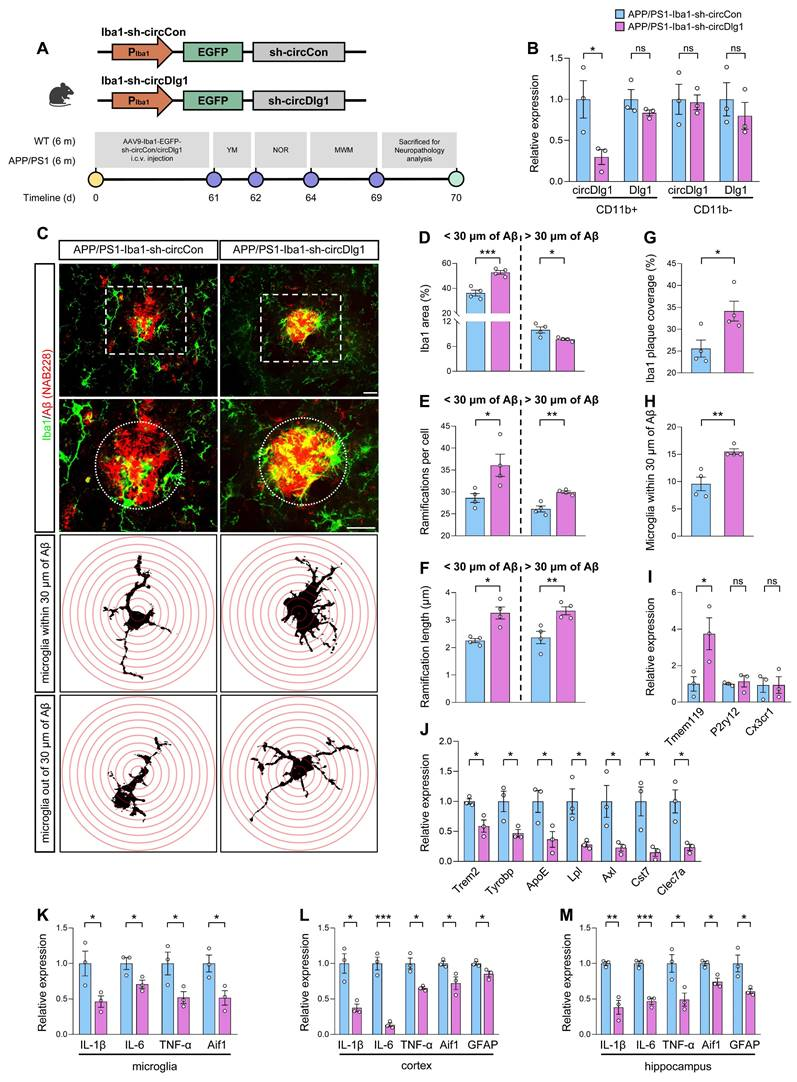
图3 小胶质细胞特异性敲低circDlg1可改善APP/PS1小鼠的小胶质细胞反应和神经炎症
随后作者开展了系统的神经病理学分析,以深入探究小胶质细胞特异性敲低circDlg1对AD相关病理的改善作用。在APP/PS1-Iba1-sh-circDlg1小鼠中,AD典型病理特征—皮层和海马区的Aβ斑块负荷显著减轻,这一现象与小胶质细胞对Aβ斑块包裹率升高相吻合。同时,小胶质细胞激活减弱和炎症因子减少共同导致星形胶质细胞活化降低以及Lamp1+营养不良性神经突减少。
为验证circDlg1敲低能否将病理改善转化为认知功能恢复,通过Y迷宫、新物体识别(NOR)和莫里斯水迷宫(MWM)实验进行系统评估。
Y迷宫实验中,APP/PS1-Iba1-sh-circCon小鼠的自发交替率较WT对照组显著降低,而circDlg1敲低可阻止这种短期记忆衰退,四组小鼠的运动功能(总进入次数)无差异。
NOR实验同样显示,APP/PS1-Iba1-sh-circDlg1小鼠的识别记忆能力较对照组明显改善。四组小鼠游泳速度无差异,运动轨迹如图中所示。这些结果表明,小胶质细胞特异性敲低circDlg1能有效挽救APP/PS1小鼠的认知功能损伤。
MWM训练阶段,circDlg1敲低组小鼠找到隐藏平台的潜伏期显著缩短,提示空间学习能力增强;在撤除平台的探测试验中,circDlg1敲低可逆转APP/PS1小鼠在目标象限停留时间和游泳距离的减少。
四组小鼠游泳速度无差异,运动轨迹如图中所示。这些结果表明,小胶质细胞特异性敲低circDlg1能有效挽救APP/PS1小鼠的认知功能损伤。
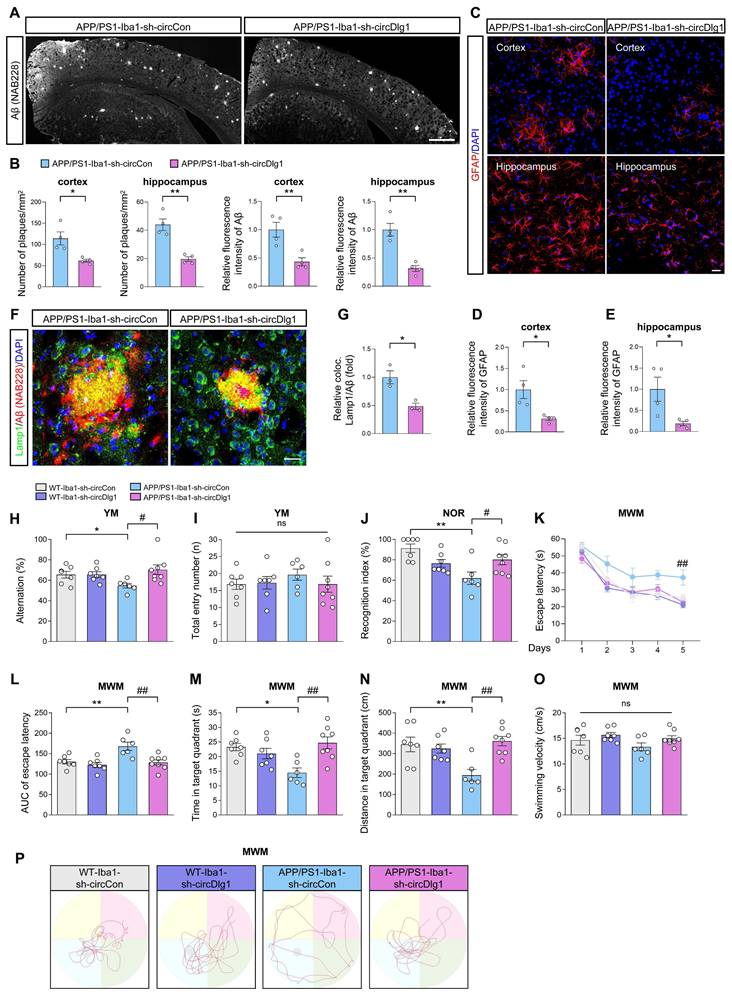
图4 小胶质细胞中circDlg1的下调可减轻APP/PS1小鼠的AD病理和认知功能障碍
鉴于circRNA普遍参与蛋白质相互作用,作者通过RNA pulldown联合质谱分析(MS)鉴定WT小鼠皮层中circDlg1的结合蛋白。
生物素标记的circDlg1探针共捕获34个蛋白,其中24个在小胶质细胞中表达。基于iBAQ定量和MS/MS计数结果,筛选出评分最高的5个候选蛋白(PDE4B、Sfpq、Hnrnpa1、Pura和Hnrnpg)。免疫共沉淀验证circDlg1与这5个蛋白均存在相互作用。值得注意的是,PDE4B的表达在LPS激活的BV-2细胞中上调最显著。RIP实验证实仅circDlg1能被PDE4B特异性捕获。FISH-免疫荧光共定位显示,circDlg1与PDE4B在BV-2细胞质中高度共定位(Pearson R=0.77)。
在PDE4B亚型中,PDE4B1-3和PDE4B5具有人鼠保守性。其中PDE4B2对炎症刺激敏感,与炎症因子和趋化因子表达密切相关,可启动小胶质细胞炎症基因表达程序。RT结果显示6月龄WT小鼠皮层小胶质细胞中PDE4B2表达量最高,其次为PDE4B3、PDE4B1和PDE4B5。在circDlg1与PDE4B质粒共转染的HEK293细胞中,RNA pulldown证实circDlg1与PDE4B1-3强结合。通过构建Flag标记的全长及截短体PDE4B1质粒,发现circDlg1特异性结合N端靶向结构域(TD)。这些结果共同表明,circDlg1通过结合PDE4B的N端TD结构域发挥调控作用。
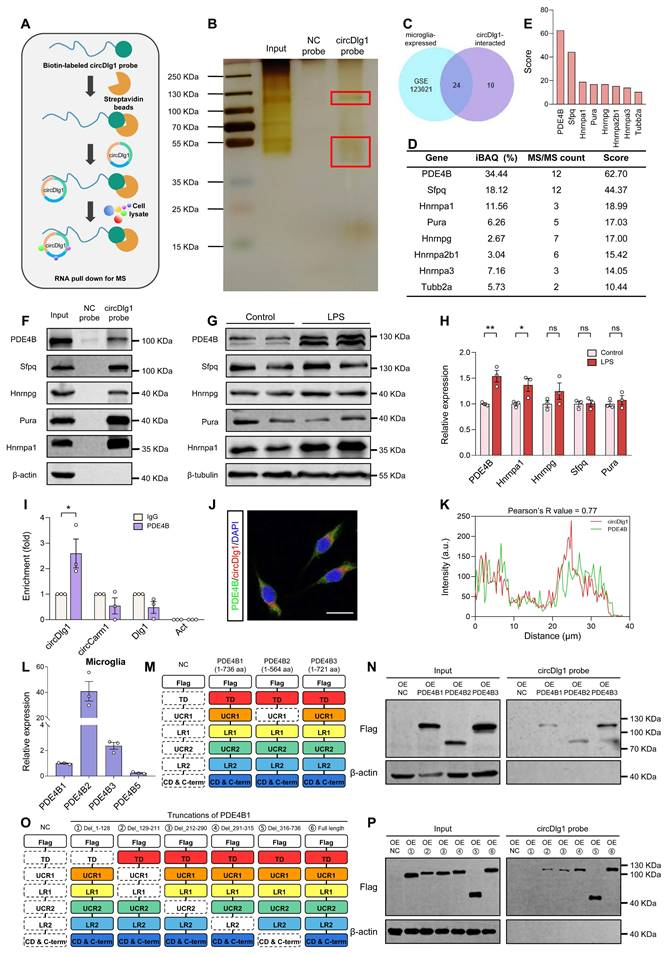
图5 CircDlg1与小胶质细胞中磷酸二酯酶4b(PDE4B)的N端靶向结构域(TD)相互作用
PDE4B是一种主要的cAMP代谢酶,主要参与调节包括小胶质细胞在内的免疫细胞的炎症反应。
为探究小胶质细胞中PDE4B敲低的作用,作者在6月龄雄性WT和APP/PS1小鼠侧脑室注射携带Iba1启动子的AAV9病毒(Iba1-shCon/Iba1-shPDE4B),2个月后评估认知功能。
EGFP与Iba1共定位及CD11b+细胞中PDE4B的mRNA表达降低证实AAV病毒感染成功。免疫染色显示,小胶质细胞特异性敲低PDE4B不影响皮层总PDE4B蛋白,但显著降低小胶质细胞内PDE4B的表达。形态学分析表明,APP/PS1-Iba1-shCon小鼠小胶质细胞呈现突起减少的异常激活态,而PDE4B敲低可明显改善这种病理形态。RT结果表明,干扰PDE4B表达后,神经炎症相关基因表达显著下调。
鉴于小胶质细胞介导的神经炎症会促进Aβ斑块生成,检测发现APP/PS1-Iba1-shPDE4B小鼠Aβ斑块沉积显著减少。莫里斯水迷宫实验显示,与对照组相比,PDE4B敲低组在4天训练阶段找到隐藏平台的潜伏期明显缩短,探测试验中目标象限停留时间延长,而游泳速度无组间差异。这些结果表明,小胶质细胞PDE4B表达下调可缓解神经炎症、减轻Aβ病理并改善APP/PS1小鼠空间学习记忆缺陷。
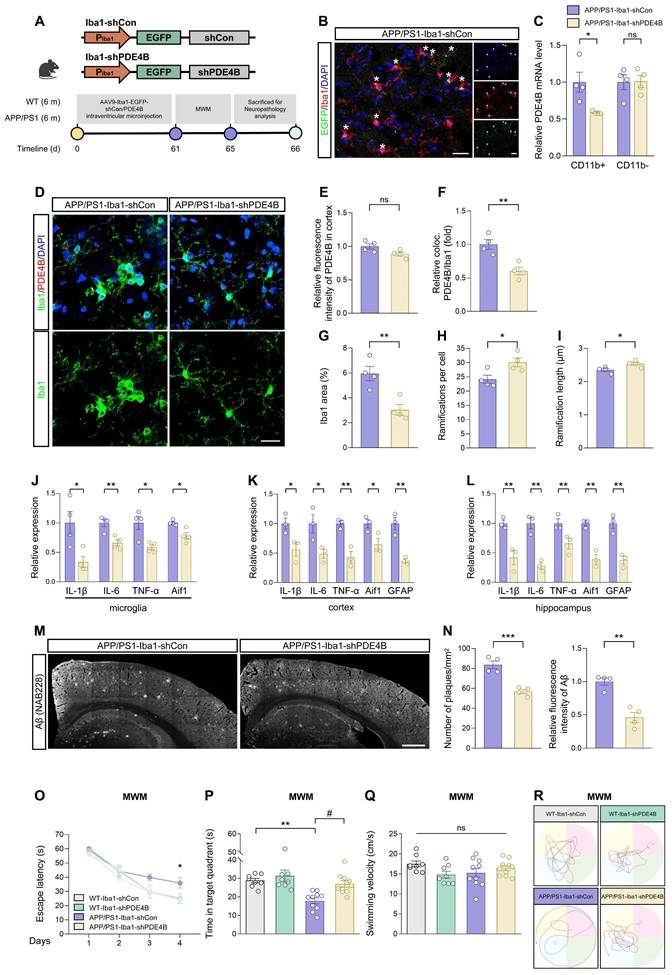
图6 小胶质细胞特异性敲除PDE4B限制了神经炎症的程度,减轻了AD病理
已有研究报道,PDE4亚型的独特N端TD结构域参与翻译后修饰过程。鉴于circDlg1通过N端TD与PDE4B结合,且PDE4B在APP/PS1小鼠小胶质细胞中起关键作用,作者深入探究了circDlg1对PDE4B的调控机制。结果显示:在小胶质细胞中,circDlg1敲低可降低PDE4B蛋白水平,而过表达则增加其表达,但均不影响PDE4B的mRNA水平,提示存在翻译后修饰机制。
使用蛋白质合成抑制剂放线菌酮(CHX)处理发现,circDlg1 siRNA处理的BV-2细胞中PDE4B蛋白降解速率加快;而转录抑制剂AcD处理下,circDlg1 siRNA对PDE4B mRNA水平无影响,表明circDlg1主要调控PDE4B蛋白稳定性。
在泛素-蛋白酶体途径和自噬-溶酶体途径这两个蛋白降解机制中,circDlg1敲低导致的PDE4B蛋白减少可被蛋白酶体抑制剂MG-132和硼替佐米(Bort)逆转,而溶酶体抑制剂氯喹(Chlo)无此作用,说明circDlg1主要通过泛素-蛋白酶体途径调控PDE4B蛋白的降解。与此一致,细胞内cAMP水平与PDE4B蛋白呈负相关波动。
此外,circDlg1敲低显著增强PDE4B的泛素化修饰。已知E3泛素连接酶Smurf2可特异性促进PDE4B的泛素化降解,RNA pulldown实验证实circDlg1与Smurf2存在相互作用,三者形成circDlg1-PDE4B-Smurf2三元复合体。值得注意的是,circDlg1敲低虽不改变Smurf2蛋白水平,但能增强PDE4B与Smurf2的结合。这些结果表明,该三元复合体通过阻碍PDE4B的泛素化依赖性降解维持其蛋白稳定性。
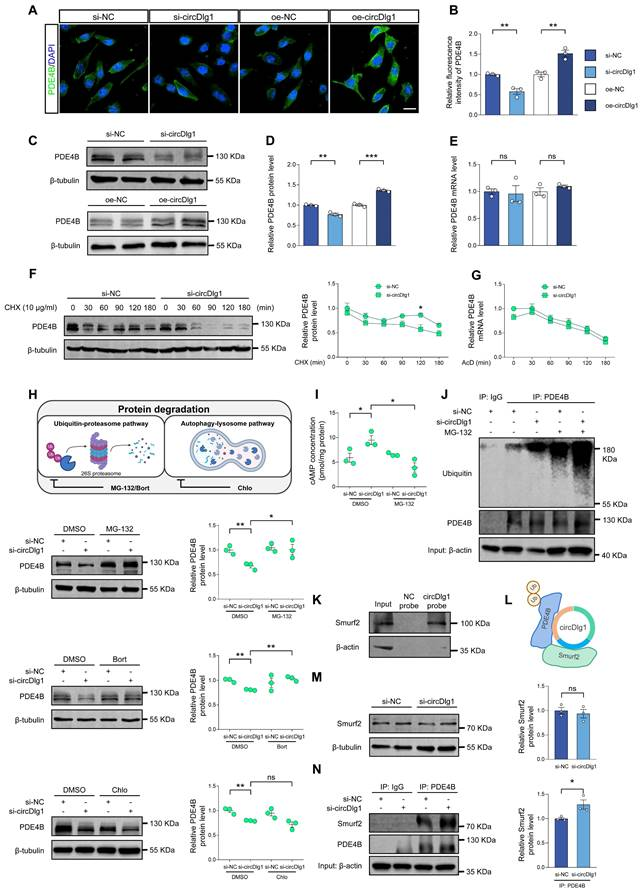
图7 CircDlg1保护PDE4B免受泛素依赖性降解
鉴于小胶质细胞PDE4B敲低可激活PKA/CREB抗炎通路,且circDlg1调控PDE4B蛋白水平,作者在体内验证了circDlg1-PDE4B调控通路。
免疫荧光显示,小胶质细胞中circDlg1下调虽不影响皮层总PDE4B荧光强度,但显著降低小胶质细胞内PDE4B的表达。CD11b+细胞、CD11b-细胞及皮层/海马组织中PDE4B的mRNA表达均无变化。Western blot进一步证实,仅APP/PS1-Iba1-sh-circDlg1小鼠的CD11b+小胶质细胞中PDE4B蛋白表达减少。
机制上,小胶质细胞特异性敲低circDlg1可显著增加磷酸化PKA(p-PKA)及磷酸化CREB(p-CREB)的蛋白表达水平,表明PDE4B下游关键的PKA/CREB抗炎信号通路被激活。相关性分析显示,circDlg1表达与p-PKA、p-CREB呈显著负相关,且circDlg1敲低促使p-PKA在胞质和核内分布增加。此外,circDlg1水平与PDE4B呈正相关,与记忆保持能力呈负相关。这些结果证实,下调小胶质细胞circDlg1可通过降低PDE4B蛋白水平,激活PKA/CREB抗炎信号通路,从而改善APP/PS1小鼠的AD神经病理。
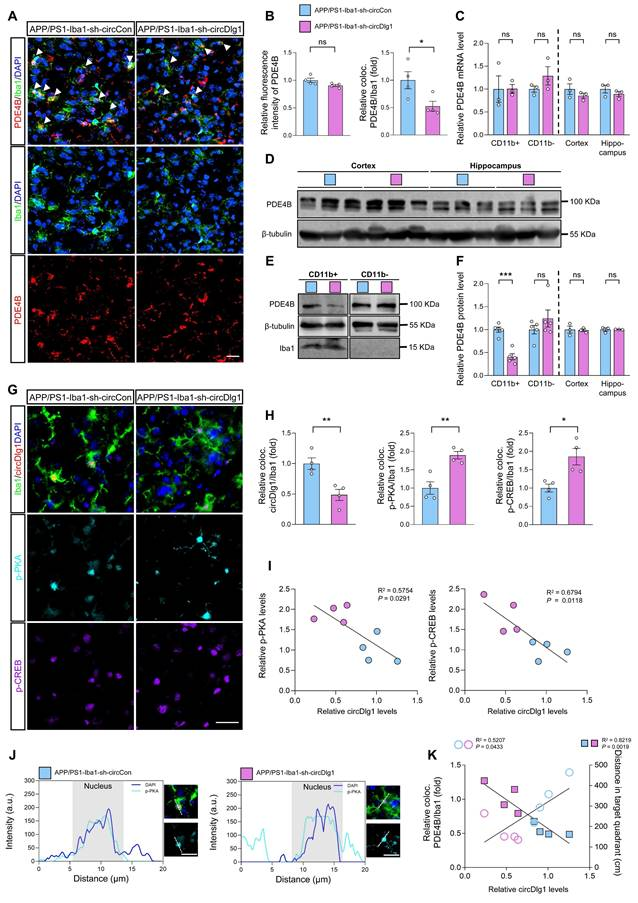
图8 APP/PS1小鼠中小胶质细胞特异性敲除circDlg1通过下调PDE4B激活PKA/CREB抗炎信号通路
研究结论
本研究首次揭示AD患者及APP/PS1小鼠小胶质细胞中异常上调的circDlg1,并证实特异性敲低该circRNA或其下游效应分子PDE4B,即可维持小胶质细胞的保护性应答、抑制促炎基因程序、减轻AD神经炎症,从而拓展了对AD小胶质细胞中circRNA特异性调控的认知边界。另外,circDlg1通过N端TD结构域调控PDE4B泛素化修饰的发现,将为开发更精准安全的AD靶向治疗策略提供全新理论依据。
原文引用
“CircDlg1, Flag-PDE4B1, Flag-PDE4B2, Flag-PDE4B3, and truncations of Flag-PDE4B1 plasmids were purchased from Genomeditech Co. Ltd (Shanghai, China). ”
文献原文
https://pubmed.ncbi.nlm.nih.gov/40093898/
声明:此推文仅代表作者个人观点,如有不科学之处,联系小编敬请指正!














