文献解读
KRAS一直被认为是“不可成药”的靶点,主要是因为它光滑的表面阻止了共价结合,并且对三磷酸鸟苷(GTP)具有高亲和力,这使得直接抑制变得困难。
随着KRASG12C蛋白中新口袋的发现,半胱氨酸12特异性残基允许抑制剂与这种突变共价结合,从而产生了革命性的KRASG12C特异性药物。Sotorasib是第一个获得FDA批准的选择性靶向KRASG12C的KRAS抑制剂,为治疗KRAS驱动的癌症开辟了道路。
KRAS蛋白
KRAS蛋白由两个关键功能域组成:N端催化结构域(G结构域)和C端高变区(HVR)。
G结构域 负责结合GTP,在激活下游信号通路中起着核心作用,其包括磷酸结合环(P-loop)、Switch I和Switch II区。大多数与癌症相关的KRAS突变位于P环和Switch II区域。
C端HVR 包含一个CAAX基序,主要与膜定位相关。该区域有助于KRAS 正确锚定到质膜的内表面。
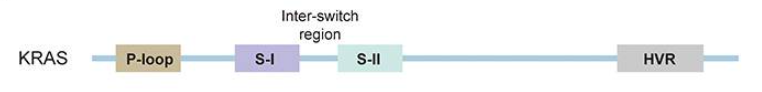
图1 KRAS蛋白结构
KRAS突变
KRAS突变最常见于胰腺癌(PDAC)、结直肠癌(CRC)和非小细胞肺癌(NSCLC)。
目前KRAS抑制剂主要被批准用于NSCLC,其中针对大部分针对于KRASG12C突变。KRASG12C占所有KRAS突变的39%,在肺腺癌(LUAD)中的患病率约为13%,其次是KRASG12V和KRASG12D;
致癌KRAS突变是胰腺癌(PDAC)中最常见的基因突变,存在于90%以上的病例中。KRASG12D和KRASG12V占主导地位,分别约占KRAS突变的42%和32%;大约30-44%的CRC(结直肠癌)病例中出现KRAS突变。
KRAS突变的频率也因地域而异,全球中位发病率为38%。据报道,北美的区域突变率为37.4%,南美为41.4%,欧洲为38.0%,日本和亚太地区为40.7%,中东为37.3%。
“不可成药性”及其挑战
自KRAS基因于1982年被确定为人类肿瘤中的致癌基因,近四十年后,第一个针对特定KRAS突变的抗癌药物才成功开发出来。
靶向KRAS的挑战源于其生物学特性,例如缺乏深结合口袋的光滑表面及高亲和力GTP结合活性,使得小分子抑制剂的开发变得特别困难。因此,KRAS长期以来一直被认为是“不可成药”的靶点。
直到2013年,报道了KRASG12C突变体的革命性抑制剂。在KRASG12C蛋白的Switch-II区下新发现的口袋可以和潜在的抑制剂特异性结合,但不与野生型KRAS结合,这个发现为KRAS抑制剂药物的开发铺垫了道路。
KRAS突变影响细胞代谢
KRAS突变和糖酵解
致癌KRAS促进糖酵解的主要机制之一是通过葡萄糖转运蛋白(GLUT,特别是GLUT1)的上调,GLUT1可以促进葡萄糖摄取;
除此之外,KRAS突变还上调糖酵解途径中的关键酶,例如己糖激酶(HK)、磷酸果糖激酶-1(PFK1)和乳酸脱氢酶A(LDHA),这些酶可以驱动葡萄糖转化为丙酮酸并最终转化为乳酸。
HK1和HK2是糖酵解途径中的第一批酶,它们通过磷酸化葡萄糖并将其留在细胞内,防止外排。由于KRAS驱动的肿瘤依赖于糖酵解途径来产生能量和生物合成,因此在KRAS驱动的肿瘤中靶向糖酵解已成为一种很有前途的策略。
KRAS突变和谷氨酰胺代谢
谷氨酰胺是循环中最丰富的氨基酸,是合成必需细胞成分(包括线粒体代谢物、非必需氨基酸、核苷酸和脂肪酸)的关键碳和氮来源。这个过程对于细胞复制、氧化还原平衡和关键信号通路的激活至关重要。
致癌KRAS突变对癌细胞代谢进行重编程,增强谷氨酰胺的摄取,谷氨酰胺通过谷氨酰胺酶(GLS)转化为谷氨酸,谷氨酸可直接进入TCA循环,这使得KRAS突变癌细胞能够维持生长所需的ATP和中间体的生物合成。除了谷氨酰胺代谢之外,线粒体氧化还原稳态是KRAS驱动肿瘤的一个关键特征。
线粒体是ROS的主要来源,KRAS突变导致的ROS水平升高并诱导氧化损伤和细胞死亡。为了抵消这一点,KRAS 驱动的肿瘤依靠谷氨酰胺分解维持氧化还原平衡。KRAS突变癌症的代谢依赖性也产生了针对线粒体功能的新型治疗方法。比如通过使用干扰线粒体蛋白质合成的替加环素等药物抑制线粒体生物发生和功能;靶向维持TCA循环的线粒体酶等。预测未来的治疗策略,KRAS驱动的肿瘤的治疗前景可能会将线粒体靶向治疗作为联合治疗方法的一部分。
KRAS突变和脂质代谢
肿瘤细胞通过代谢重编程以满足其增加的能量需求,而脂质代谢是关键组成部分。在癌细胞中常见的脂质代谢特征改变是脂质合成、摄取、储存和降解过程增强,这导致了它们的侵袭性表型。
脂肪酸合成(FAS)在癌细胞中被激活。一些涉及FAS的关键酶已成为靶向脂质代谢的有吸引力的癌症管理疗法,例如乙酰辅酶A羧化酶(ACC)或脂肪酸合酶(FASN);了靶向脂质合成外,专注于脂肪酸摄取(特别是通过CD36)是另一种很有前途的方法。
CD36是一种跨膜蛋白,可结合细胞外脂质并通过内吞作用促进脂肪酸摄取。针对CD36的中和抗体几乎完全抑制了免疫缺陷或免疫功能正常的原位人口腔癌小鼠模型的转移。
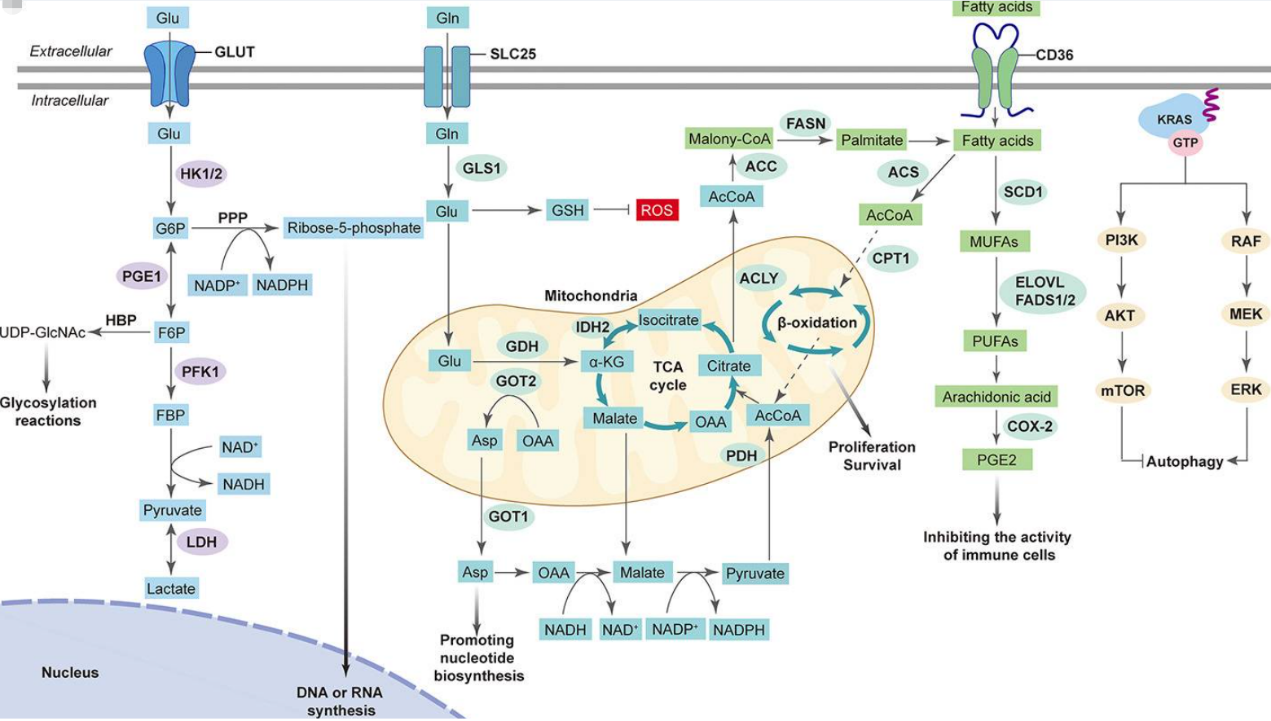
图2 受致癌KRAS影响的葡萄糖、谷氨酰胺和脂质代谢途径
KRAS突变和自噬
在KRAS驱动的肿瘤中,自噬已成为一种关键的生存机制。KRAS突变通过诱导对营养和能量的高需求来支持其快速增殖,从而在癌细胞中造成代谢脆弱性。这种代谢应激,再加上TME中缺氧和营养匮乏等环境因素,增加了KRAS突变癌细胞对自噬的依赖,从而维持其代谢需求并维持细胞稳态。
KRAS突变和肿瘤微环境
在KRAS驱动的癌症中,代谢变化包括增强糖酵解、谷氨酰胺成瘾和脂质合成,从而产生一种不仅可以满足癌细胞营养需求,还可以促进免疫逃避的TME。因此,KRAS突变癌症通常对常规疗法和免疫疗法具有耐药性,这凸显了解决这些代谢依赖性靶向策略的必要性。
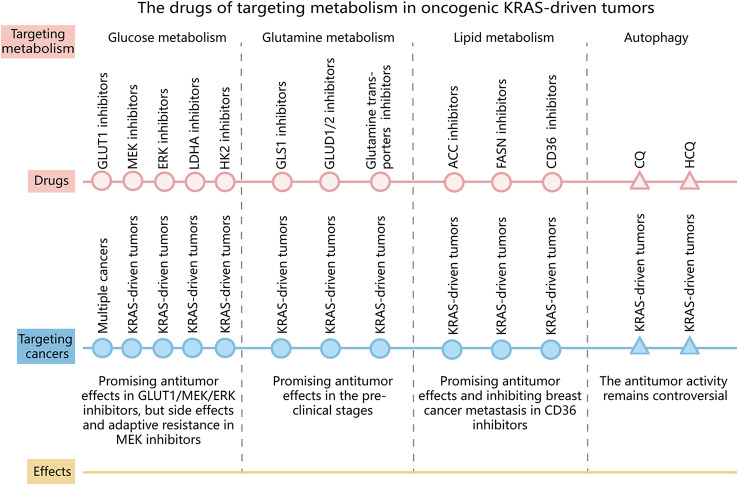
图3 靶向致癌KRAS驱动肿瘤中的代谢途径。
圆圈代表积极影响,三角形代表积极或消极影响
靶向KRAS的治疗策略
Sotorasib
sotorasib是第一个获得FDA批准的KRASG12C抑制剂,其问世代表了靶向KRAS突变的重大突破。
Sotorasib不可逆地结合KRASG12C的突变半胱氨酸,改变Switch-I/II区的构象。与GTP相比,这种结合增加了KRAS对GDP的亲和力,有效地将KRAS锁定在非活性状态并损害下游信号通路。
Sotorasib(AMG510)首次在NSCLC中显示出疗效,其中约13%的病例存在KRASG12C突变。临床研究表明,既往接受过治疗的NSCLC患者的反应率相当高,疾病控制率高达80%,中位无进展生存期(PFS)约为6.8个月。通过类似的机制,adagrasib(MRTX849)将KRASG12C维持在非活性状态,从而阻断癌细胞生长所必需的下游信号传导。尽管取得了这些进步,但由于获得性耐药的快速发展,基于sotorasib和adagrasib的疗法面临重大挑战。临床数据表明,耐药性是通过KRAS的继发突变或替代信号通路的激活出现的。
sotorasib和其他KRASG12C特异性抑制剂的成功依赖于Cysine-12口袋,而其他类型的KRASG12突变蛋白中不存在。因此,KRASG12D、KRASG12V、KRASG13D和KRASQ61H等KRAS突变体的变异使KRAS抑制剂的设计非常复杂。目前针对pan-KRAS的抑制剂也在紧急研制中,比如RMC-6236、BI-2865、BI-3706674 、ADT-007 等。
“KRAS-on”抑制剂
“KRAS-on”抑制剂的开发提供了一种新的治疗策略。与靶向非活性GDP结合形式的“KRAS-off”抑制剂不同,“KRAS-on”抑制剂靶向KRAS的活性GTP结合状态。例如,RMC-6291通过与KRASG12C(ON)和亲环蛋白A(CypA)形成三复合物来阻断与RAS效应子结合,从而阻止下游通路的激活,从而靶向活性KRAS。
临床前数据表明,RMC-6291表现出比“KRAS-off”药物更好的疗效,可能为获得性耐药提供替代疗法。另一种“KRAS-on”抑制剂RM-018通过与KRASG12C/Y96D结合来克服KRAS继发突变(如KRASY96D)引起的耐药性。
其他治疗策略
靶向KRAS-PDEδ相互作用也已成为KRAS驱动癌症中一种很有前途的治疗策略。抑制这种相互作用会破坏KRAS定位,从而降低其致癌潜力。 Deltarasin是首批开发用于靶向PDEδ的小分子抑制剂之一,在KRAS依赖性细胞系中表现出抗肿瘤作用;然而,其特异性和细胞毒性限制促使进一步改进。虽然已经开发了更具选择性的抑制剂,提高了PDEδ口袋特异性以减少脱靶毒性,但由于细胞效力不足和代谢稳定性差,进一步开发受到限制。 最近的进展,如PROTACs(蛋白水解靶向嵌合体),使影响脂质代谢的PDEδ能够选择性降解,这可能导致抑制KRAS-PDEδ相互作用的创新方法。 挑战与机遇 由于致癌KRAS突变在调节代谢途径以支持癌细胞生长和存活中的关键作用,它长期以来一直是癌症治疗的理想靶点。 开创性的KRASG12C抑制剂,如sotorasib和adagrasib,已显示出前景,但目前仅使一小部分患者受益。遗憾的是,目前尚无批准用于治疗KRASG12D或其他突变的药物。对这些KRAS抑制剂的获得性耐药的快速发展是致癌KRAS突变患者治疗的另一个障碍。 为了克服这些问题,正在研究将治疗与靶向下游途径中分子的其他抑制剂或免疫疗法相结合,这对KRAS驱动的癌症患者具有巨大潜力。同时,确定针对更多不同KRAS相关通路和分子的潜在治疗方法也至关重要。 吉满生物 吉满生物可提供与KRAS等靶点的Ba/F3细胞系,支持KRAS抑制剂的筛选、活性验证及体外功效研究。 欢迎访问吉满生物官网:www.genomeditech.com 免费咨询电话:400-627-9288 文章来源:DOI: 10.1186/s12943-024-02216-3

















