实验干货
肝脏,作为人体的代谢中枢,不仅负责解毒、合成与储存,更是众多遗传代谢性疾病(如血友病、家族性高胆固醇血症等)的关键靶器官。
肝脏功能
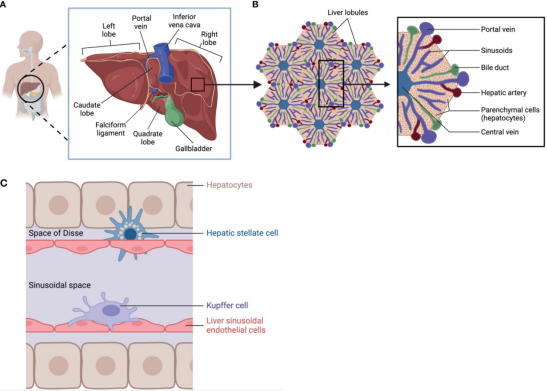
肝小叶是实现肝脏功能的基本结构单位,呈六边形,以中央静脉为中心排列,每个小叶包含胆管、肝卖、肝门静脉分支和肝动脉,构成复杂的
微循环系统。
小叶中有几种细胞类型,通常可分为实质细胞(PC)和非实质细胞(NPC)。
实质细胞:包括肝细胞和胆管细胞,其中肝细胞占所有肝脏细胞的70%,负责大部分的肝代谢功能。
肝脏解剖、小叶结构和细胞类型[1]
研究工具
腺相关病毒(AAV)因其安全性高、表达持久等特点,已成为肝脏靶向科学研究中备受青睐的基因递送工具。
腺相关病毒(AAV)能够适应肝脏中高度组织化的结构和功能分区,将基因精准地递送至目标细胞内,实现高效特异的肝脏靶向基因操作。但要利用好这一工具,研究者必须审慎考虑三个关键环节:血清型的选择、启动子的特异性以及递送途径的优化。
血清型选择
研究发现,几乎所有血清型的AAV载体在静脉给药后都表现出有效的肝脏蓄积,这是由于它们对肝脏的固有亲和力(向肝性)[2]。
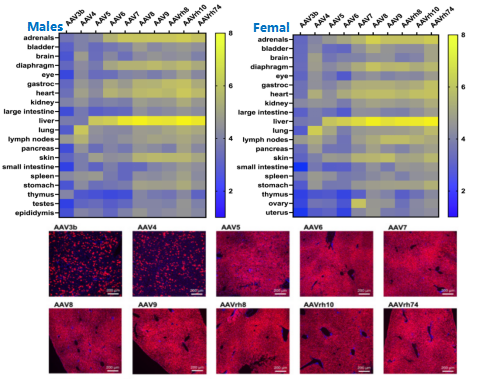
小鼠是使用最广泛的临床前模型生物,尾静脉注射结果显示,AAV5,AAV6,AAV7,AAV8,AAV9,AAVrh8,AAVrh10和AAVrh74均表现出高度肝嗜性,其中AAV8和AAVrh10转导效率最高,并且在大多数血清型中,雄性小鼠的肝脏转导比雌性小鼠更强。明显的例外是AAVrh74,它对雌性小鼠的转导产生了明显的偏好[3]。
不同血清型经尾静脉注射的跨组织转导效率
不同血清型的肝脏嗜性因物种不同而存在差异
基于AAV3衣壳工程改造的AAV3B变体似乎对小鼠肝脏的亲和力很差,但Biswas的研究表明,AAV3B对人类肝细胞表现出高度嗜性,并且增强了的对预先存在的AAV中和抗体的逃避[4]。
小鼠肝脏中AAV感染效率:AAV8 > AAV6 > AAV5 > AAV-LK03 > AAV-NP59
人类肝脏中AAV感染效率:AAV-LK03 > AAV-NP59 > AAV8 >AAV6 > AAV5[5][6]。
肝脏的不同病理形态也会影响AAV载体靶向肝脏的转导效率和特异性
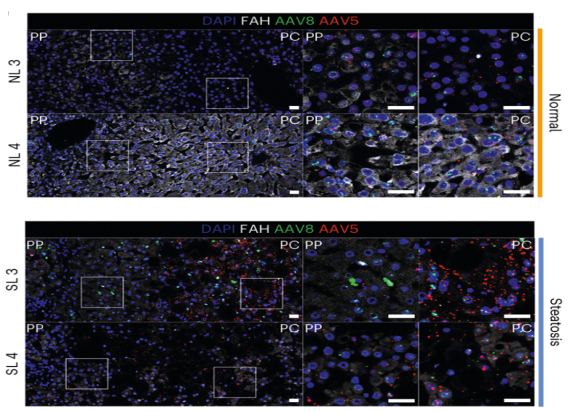
在正常肝脏中,AAV8的转导效率显著高于其他常用载体,表现出持续且稳定的基因表达。但在脂肪肝肝脏中,AAV5显示出比AAV8更高的转导效率,尤其是在肝脏的中心区域[6]。
正常和脂肪肝中AAV感染效果
PP:门静脉周围 PC:中心区域
NL:正常肝脏 SL:脂肪肝
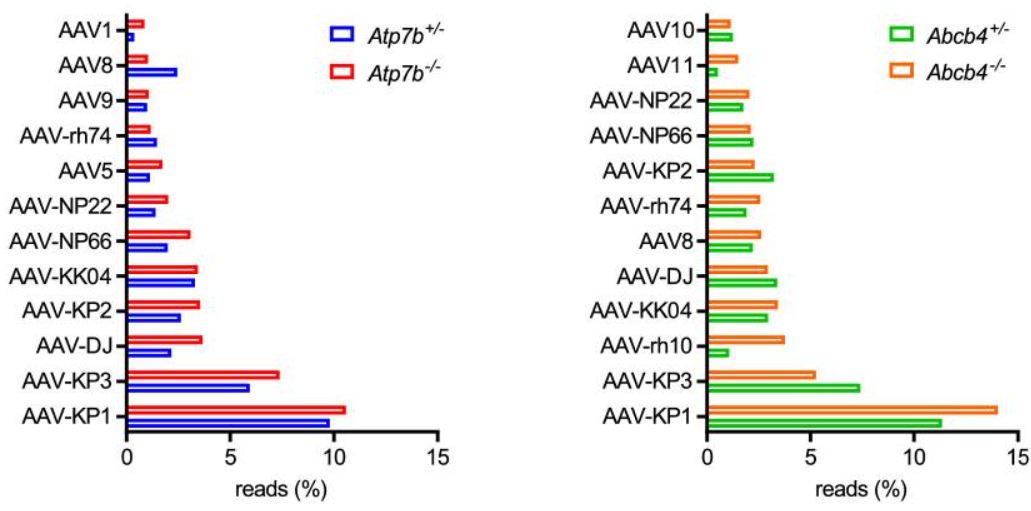
此外在肝纤维化小鼠模型中,肝纤维化严重阻碍了AAV8和AAV9载体的肝脏基因转移,并改变了器官和细胞类型水平的AAV分布,但AAV3工程化变体AAV-KP1显示出对肝脏组织持续高效的转导[7]。
肝纤维化对AAV介导的小鼠肝细胞基因转移的影响
启动子选择
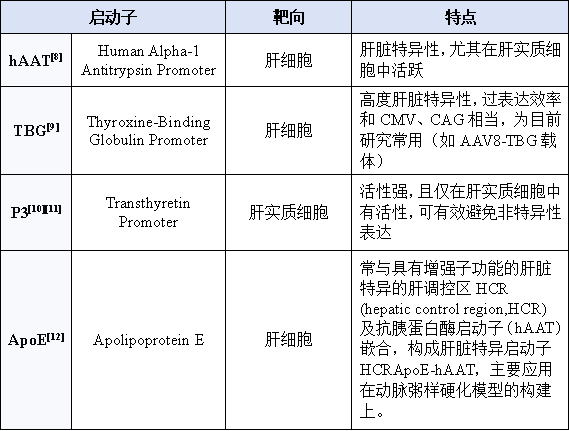
启动子决定了基因表达的组织特异性与强度,是实现高效特异的肝脏靶向的另一重要因素。
需要全局过表达或对组织表达特异性要求不高的基础研究:可选择广谱强效型启动子,如CMV、CAG、EF-1α、PGK等类型,具有广泛的宿主细胞适用范围和高效的转录激活能力,能够显著驱动外源基因在肝脏以及其他多种组织中实现高水平表达。
对组织表达部位有严格要求的研究:可选择肝脏特异性启动子,这类启动子主要在肝脏组织中表现出高度的活性,而在其他组织中则相对较弱或无活性,因而能够精准地调控基因在肝脏的特异性表达,极大程度减少脱靶效应。
肝脏特异性启动子
注射方式
靶向肝脏的感染方式可分为直接递送和外周递送。其中尾静脉注射和腹腔注射是目前应用比较广泛的注射方式,操作者也可根据实验目的选择合适的注射方式。
此外,常温体外灌注(Normothermic Machine Perfusion,NMP)技术近年来被广泛应用于器官保存和功能评估,尤其在肝脏研究中展现出巨大潜力。该技术通过灌注氧合血细胞、白蛋白、激素和营养物质等溶液,在24小时以上的时间内维持肝脏的生理活性,使得研究人员能够在接近真实生理条件下进行长期的实验研究[6]。
靶向肝脏的AAV递送方式
客户案例
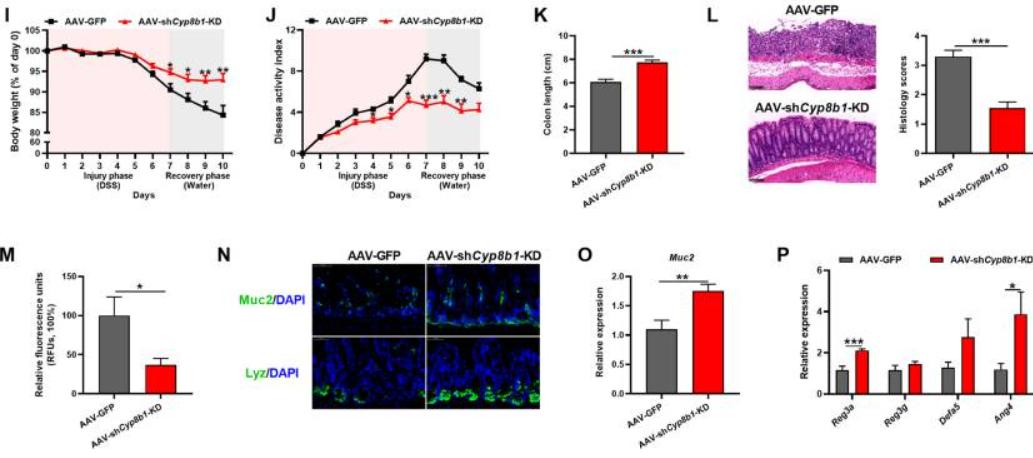
案例一:Hepatic cytochrome P450 8B1 and cholic acid potentiate intestinal epithelial injury in colitis by suppressing intestinal stem cell renewal[9]
研究背景
炎症性肠病(IBD)如溃疡性结肠炎,是一种特发性和复发性疾病,其核心病理特征之一是肠上皮屏障的严重破坏与修复障碍。前人研究观点表明,胆汁酸(BAs)体内平衡的破坏与IBD有关,BAs代谢对肠道上皮的自我更新具有潜在影响。然而,作为BAs合成关键节点的肝脏酶类CYP8B1及其产生的初级胆汁酸——胆酸(CAs),是否直接参与疾病进程,特别是能否跨越“肝-肠”距离直接调控肠道干细胞的功能,是一个尚未被充分阐明的科学问题。
研究方法
该研究依托腺相关病毒(AAV)载体,成功构建了肝脏CYP8B1特异性敲除与过表达的小鼠模型。
实验动物:5-6周龄小鼠
血清型:AAV9(干扰)
注射方式:尾静脉注射
注射量:1E11vg/mice
检测时间:4周后处理
研究结论
在机制上,研究团队证明了肝脏CYP8B1-CA途径通过抑制过氧化物酶体增殖物激活受体α(PPARα)依赖性脂肪酸氧化(FAO)抑制肠上皮再生,并最终促进结肠炎。这一发现不仅揭示了“肝-肠轴”在IBD发病过程中的新机制,也为研发靶向肝脏酶类的IBD治疗策略提供了理论支撑。
敲除肝脏CYP8B1有助于缓解结肠炎
吉满助力: AAV2/9-CMV-eGFP(AAV-GFP)、 AAV2/9-CMV-m-Cyp8b1-shRNA(AAV-shCyp8b1-KD)
案例二:PXR activation impairs hepatic glucose metabolism partly via inhibiting the HNF4 α-GLUT2 pathway[13]
研究背景
葡萄糖代谢平衡对维持机体能量稳定至关重要,肝脏是调控血糖的核心器官。PXR受体主要介导外源性化合物的代谢与清除,在肝脏和小肠中高表达,但越来越多的证据表明,它的激活也会引起血糖异常和胰岛素抵抗,这种现象在临床上表现为“药物性糖尿病”。然而,PXR具体如何干扰肝脏内部的葡萄糖代谢通路,其直接分子机制尚不清楚。
研究方法
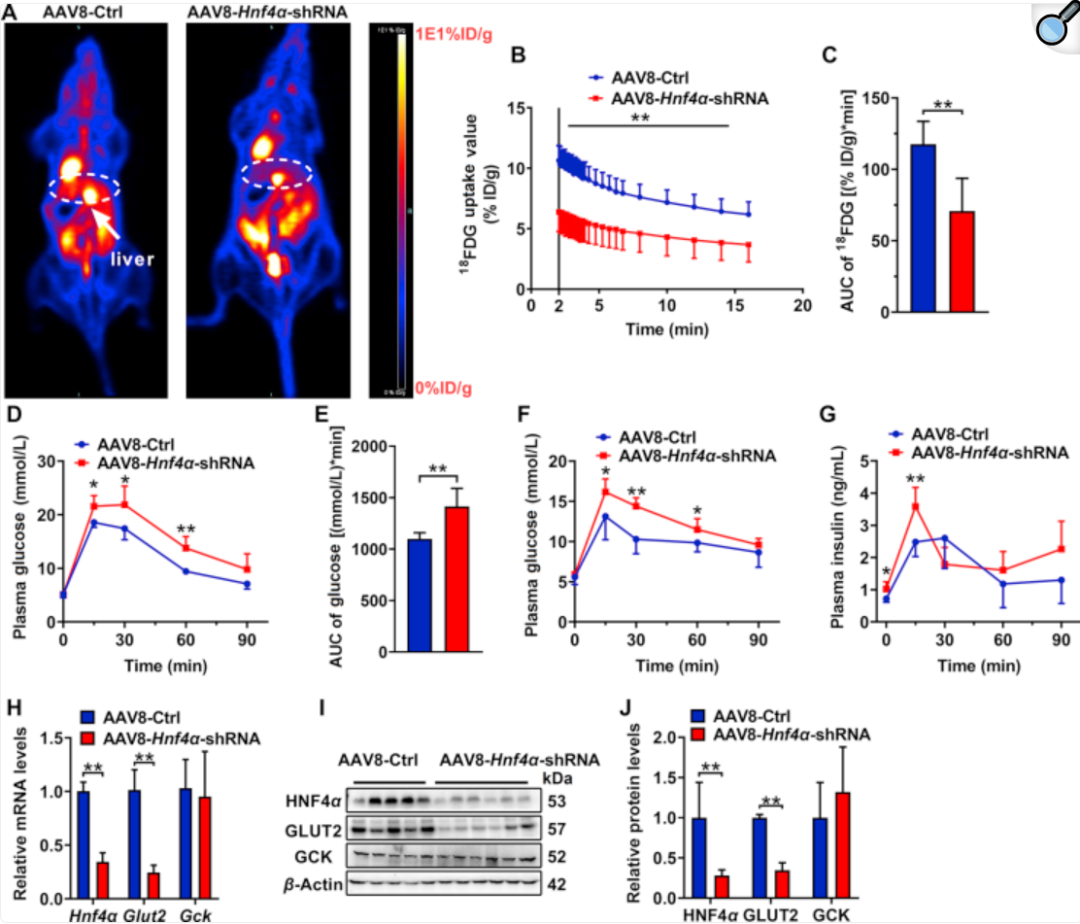
该项研究借助AAV病毒实现对小鼠肝脏中HNF4α的特异性敲除,从而在活体动物水平上清晰地证实了PXR通过直接干扰HNF4α的功能来抑制GLUT2表达的分子途径,为理解药物激活PXR受体引发高血糖副作用提供了全新的机制解释。
实验动物:6 周龄雄性 C57BL/6J 小鼠
血清型:AAV8(干扰)
注射方式:肝门静脉内注射
注射体积:200µL
注射量:5E11vg
研究结论
该研究在活体动物水平上清晰地证实了PXR通过直接干扰HNF4α的功能来抑制GLUT2表达的分子途径,为理解药物激活PXR受体引发高血糖副作用提供了全新的机制解释。不仅深化了对药物性糖尿病发病机理的认识,也提示HNF4α及其下游通路可能成为预防或治疗药物性代谢副作用的新靶点。
肝脏HNF4α表达缺失损害C57BL/6J小鼠的葡萄糖耐量和肝脏葡萄糖摄取
吉满提供:AAV8-Hnf4α-shRNA、PGL4.10-M_Slc2a2荧光素酶报告基因载体、pEX-3-HNF4α过表达质粒 吉满服务 吉满生物拥有十四年的病毒包装服务经验,不仅提供包括过表达、RNA干扰(shRNA)、Cre-Loxp系统等多种功能在内的AAV定制服务,还有超多AAV现货产品,覆盖从基础功能研究到复杂疾病模型构建的广泛需求。 吉满优势 高效的血清型选择:提供经实验验证的、对肝脏组织具有高亲和力的AAV血清型(如AAV8, AAV9, AAV-Rec等),确保高效递送。 灵活的启动子库:拥有种类丰富的广谱启动子和肝脏特异性启动子,同时提供Cre-Loxp、shRNA、Cas9-sgRNA、过表达等丰富的现货与定制服务。 可靠的质量与交付:采用AAV Helper-Free System和三质粒共转染技术,确保高安全性;病毒滴度可达1×10¹³ vg/mL,提供详尽的质检数据(滴度、纯度、活性验证等)。 完善的客户服务体系:拥有经验丰富的技术团队,提供从技术支持、项目跟进到售后服务的一对一全流程服务,助力客户论文发表超2000篇。 参考资料: [1] Alabdulaali B, Al-Rashed F, Al-Onaizi M, et al. Macrophages and the Development and Progression of Non-Alcoholic Fatty Liver Disease. Frontiers in Immunology. 2023, 14: 1195699. DOI: 10.3389/fimmu.2023.1195699. [2] Hadi M, Qutaiba B A O, Jabari M, et al. Recent Advances in Various Adeno-Associated Viruses (AAVs) as Gene Therapy Agents in Hepatocellular Carcinoma. Virology Journal. 2024, 21(01): 17. DOI: 10.1186/s12985-024-02286-1. [3] Walkey C J, Snow K J, Bulcha J, et al. A Comprehensive Atlas of AAV Tropism in the Mouse. Molecular Therapy. 2025, 33(03): 1282-1299. DOI: 10.1016/j.ymthe.2025.01.041. [4] Biswas M, Marsic D, Li N, et al. Engineering and In Vitro Selection of a Novel AAV3B Variant with High Hepatocyte Tropism and Reduced Seroreactivity. Molecular Therapy-methods & Clinical Development. 2020, 19: 347-361. DOI: 10.1016/j.omtm.2020.09.019. [5] Lisowski L, Dane A P, Chu K, et al. Selection and Evaluation of Clinically Relevant AAV Variants in a Xenograft Liver Model. Nature. 2014, 506(7488): 382-386. DOI: 10.1038/nature12875. [6] Kim J J, Kurial S N T, Choksi P K, et al. AAV Capsid Prioritization in Normal and Steatotic Human Livers Maintained by Machine Perfusion. Nature Biotechnology. 2025, Online ahead of print. DOI: 10.1038/s41587-024-02523-6. [7] Ferriero R, Bruno G, Padula A, et al. Impact of Liver Fibrosis on AAV-Mediated Gene Transfer to Mouse Hepatocytes. Nature Communications. 2025, 16(01): 2118. DOI: 10.1038/s41467-025-57382-9. [8] Xia Y, He J, Zhang H, et al. AAV-Mediated Gene Transfer of DNase I in the Liver of Mice with Colorectal Cancer Reduces Liver Metastasis and Restores Local Innate and Adaptive Immune Response. Molecular Oncology. 2020, 14(11): 2920-2935. DOI: 10.1002/1878-0261.12787. [9] Chen L, Jiao T, Liu W, et al. Hepatic Cytochrome P450 8B1 and Cholic Acid Potentiate Intestinal Epithelial Injury in Colitis by Suppressing Intestinal Stem Cell Renewal. Cell Stem Cell. 2022, 29(09): 1366-1381.e9. DOI: 10.1016/j.stem.2022.08.008. [10] Wang X, Delle C, Asiminas A, et al. Liver-Secreted Fluorescent Blood Plasma Markers Enable Chronic Imaging of the Microcirculation. Cell Reports Methods. 2022, 2(10): 100302. DOI: 10.1016/j.crmeth.2022.100302. [11] Xu X, Tang H, Guo J, et al. A Dual-Specific CRISPR-Cas Nanosystem for Precision Therapeutic Editing of Liver Disorders. Signal Transduction and Targeted Therapy. 2022, 7(01): 269. DOI: 10.1038/s41392-022-01071-2. [12] Kumar S, Kang D W, Rezvan A, et al. Accelerated Atherosclerosis Development in C57Bl6 Mice by Overexpressing AAV-Mediated PCSK9 and Partial Carotid Ligation. Laboratory Investigation; A journal of Technical Methods and Pathology. 2017, 97(08): 935-945. DOI: 10.1038/labinvest.2017.47. [13] Liu P, Jiang L, Kong W, et al. PXR Activation Impairs Hepatic Glucose Metabolism Partly via Inhibiting the HNF4α-GLUT2 Pathway. Acta Pharmaceutica Sinica b. 2022, 12(05): 2391-2405. DOI: 10.1016/j.apsb.2021.09.031.