靶点专栏
TSHR是一种细胞表面糖蛋白受体,属于G蛋白偶联受体(GPCR)的富含亮氨酸重复序列(LGR)亚家族。[1]
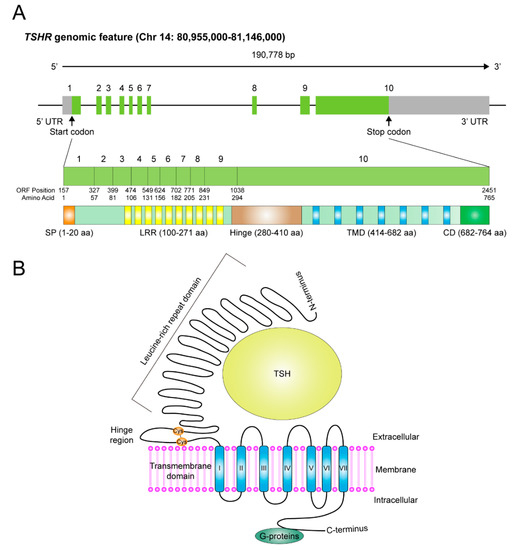
TSHR基因中有10个外显子。前九个构成从氨基末端开始的胞外结构域(细胞外区域),而第十个外显子编码七个跨膜片段以及包含胞浆内结构域的羧基末端区域(图1A)。TSHR 基因编码 764 个氨基酸残基的全长蛋白质,分子量为 87 kDa。
促甲状腺激素受体(TSHR)的基因组特征和蛋白质结构
TSHR主要分布在甲状腺滤泡细胞的基底外侧膜上,研究进展广泛。TSHR在多种非甲状腺癌组织(包括黑色素瘤、神经胶质瘤、肺癌、乳腺癌、卵巢癌和肝癌)中的表达和功能作用已有报道。[2]
信号转导通路机制
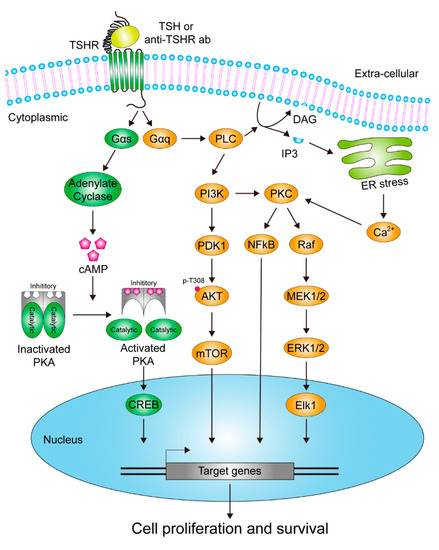
TSHR作为A家族G蛋白偶联受体,其在甲状腺生理中的激活源于多种配体,并通过下游经典的G蛋白信号级联,调控甲状腺细胞的生长与激素合成,其激活机制具有多源性:除循环TSH这一生理性配体外,还包括自身免疫性疾病中的刺激性抗体、导致受体自主活性的基因突变,以及一种高亲和力配体——甲状腺刺激蛋白。
甲状腺细胞中 TSHR 激活的已识别信号通路
TSHR的下游信号转导主要依赖于Gαs-cAMP-PKA通路与Gαq通路。
Gαs通路通过激活腺苷酸环化酶-cAMP-蛋白激酶A(PKA)轴,磷酸化转录因子CREB,进而驱动与激素合成及细胞增殖相关的基因表达。
Gαq通路则通过激活磷脂酶C(PLC),生成IP3与DAG以激活蛋白激酶C(PKC),并联动MAPK与PI3K-AKT信号级联,共同促进细胞的增殖与生存。
这两大通路并非孤立运作,而是构成了一个精细的协同调控网络:
Gαs/cAMP/PKA通路主要负责调控甲状腺细胞的分化和特异性功能(如激素合成),而Gαq/PLC/PKC通路则更侧重于驱动细胞的增殖与生存信号。
二者的协同与平衡,对于维持甲状腺正常的生理状态、执行激素分泌功能以及控制组织生长至关重要,其失调是导致甲状腺功能亢进、甲状腺肿乃至甲状腺癌等疾病的核心环节。
研究进展
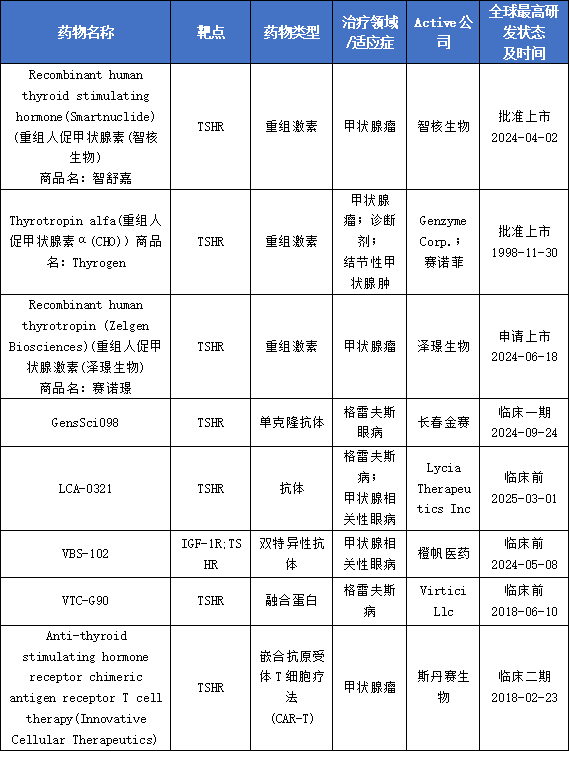
随着对甲状腺刺激激素受体(TSHR)生物学特性的深入理解,以其为靶点的药物研发已从传统的内分泌治疗,成功拓展至肿瘤免疫治疗和自身免疫性疾病领域,形成了多元化的治疗格局。
最新药物进展
在TSHR靶向药物研发领域,橙帆医药取得了具有代表性的进展。其核心双抗VBS-102(OLN102)以4.4亿美元授权美国Ollin Biosciences,后者完成1亿美元融资用于全球开发,体现了TSHR作为甲状腺代谢调控关键因子的科研与商业价值。
此外,近期泽璟制药与德国默克合作商业化重组人促甲状腺激素(rhTSH),用于分化型甲状腺癌,项目已获NMPA受理,默克获中国独家权利。上述进展凸显TSHR靶点在代谢及自身免疫疾病领域的全球热度与应用潜力。
小 结
TSHR在临床和产业上的突破,根源于其在甲状腺功能调控中的关键作用。促甲状腺激素受体(TSHR)是促甲状腺素(TSH)和促甲状腺激素(thyrostimulin)的主要受体,通过调控甲状腺激素的合成与分泌,维持机体的内分泌稳态。
TSHR靶向药物的研发历程清晰地展现了从激素替代到免疫调控、从单一靶点到多机制协同的治疗理念演进。随着更多创新药物的临床推进,TSHR靶点将继续为甲状腺疾病患者带来更有效、更精准的治疗选择。
用心做好细胞,为更好的靶向药
吉满生物隆重推出TSHR系列研发工具:稳定过表达细胞系、报告基因细胞系及高品质抗体产品。覆盖靶点验证、功能研究及药物筛选全流程,助力您的研发团队高效推进新药研发与临床申报,为精准治疗研究提供坚实支持。(详情咨询吉满客服:18916119826)此处点击了解TSHR相关产品

产品列表
数据展示(部分)
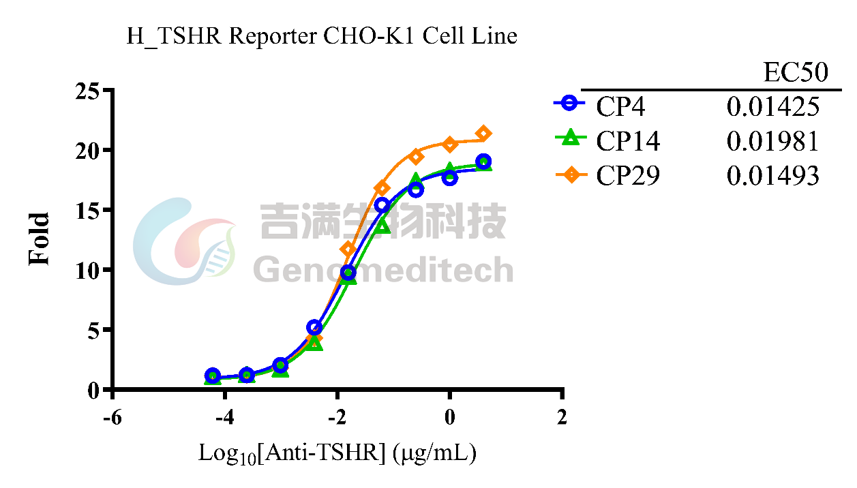
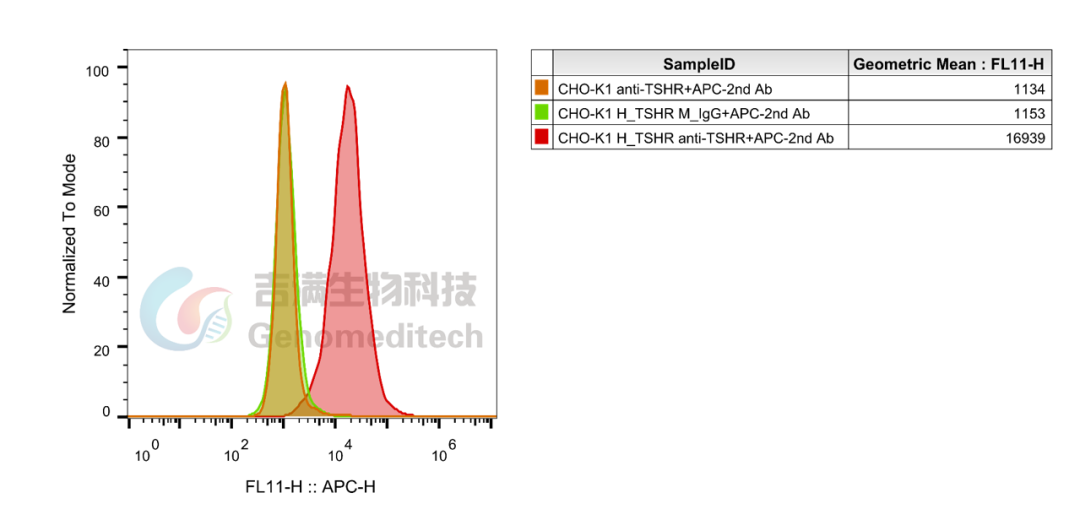
GM-C39741:H_TSHR Reporter CHO-K1 Cell Line
该细胞系已通过重组人TSH蛋白验证,功能表现优异,适用于靶点验证、药物筛选等研究。
使用Recombinant Human TSH蛋白验证结果
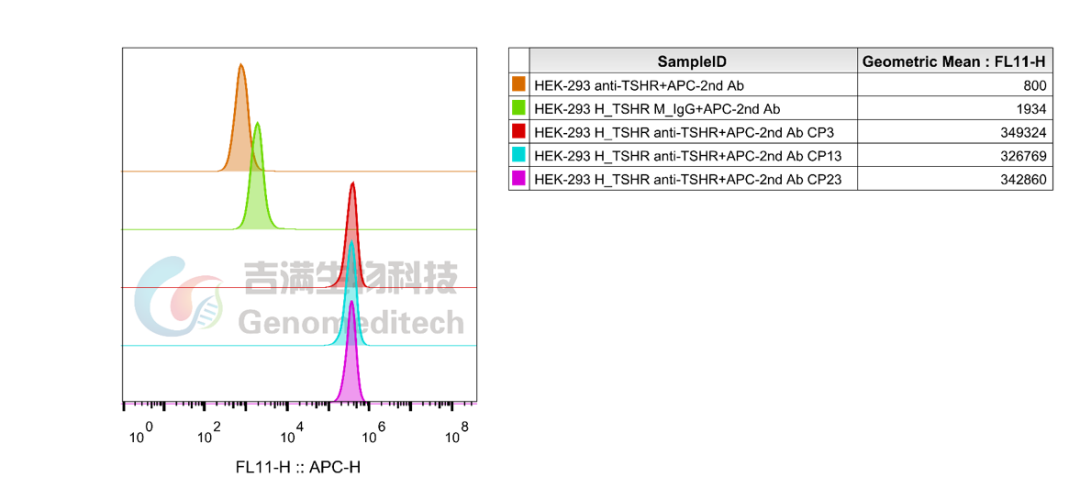
该细胞系经GM-87935AB Anti-TSHR mIgG2a抗体(KSAb2)验证,经过29代次验证,功能表现仍然稳定可靠。
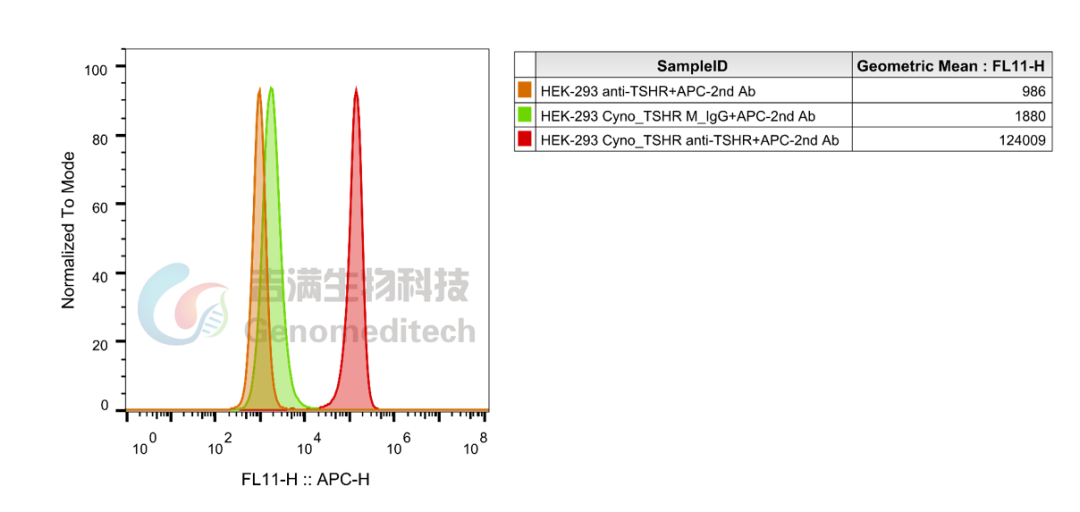
三款细胞系均经过KSAb2抗体流式验证,表达可靠,多代次验证表达仍然稳定,为TSHR靶点研究、药物筛选及机制解析提供高质量工具。
GM-C39974 : H_TSHR CHO-K1 Cell Line
GM-C39975:H_TSHR HEK-293 Cell Line
GM-C39978:Cynomolgus_TSHR HEK-293 Cell Line
联系我们
吉满生物专注为生物药开发,提供高效的研发工具和解决方案。截止当前已布局近400个热门靶向药靶点,超1000株现货单克隆细胞系,涵盖肿瘤相关抗原(TAA)、 免疫检查点、Fc受体、细胞因子和激酶等热门靶点类型。旨在助力、加速大分子早期研发,做到进口细胞的国产替代。同时构建了丰富的蛋白、抗体及试剂现货产品库。
参考资料:
[1]Chu, Y.-D., & Yeh, C.-T. (2020). The Molecular Function and Clinical Role of Thyroid Stimulating Hormone Receptor in Cancer Cells. Cells, 9(7), 1730.https://doi.org/10.3390/cells9071730
[2]Rapoport, B.; Chazenbalk, G.D.; Jaume, J.C.; Mclachlan, S.M. The thyrotropin (TSH) receptor: Interaction with TSH and autoantibodies. Endocr. Rev. 1998, 19, 673–716
[3]泽璟制药关于与德国默克达成重组人促甲状腺激素商业化合作的公告. (2025). Retrieved from https://www.zelgen.com/news/20250609
[4] 智核生物医药科技有限公司. 智舒嘉®说明书. (2024). Retrieved from https://www.smartnuclide.com/zhushujia
[5] Duntas, L. H., & Joaquim, S. (2019). Recombinant human thyrotropin in the management of thyroid cancer. Current Opinion in Endocrinology, Diabetes and Obesity, 26(5), 275-281.
[6] 金赛药业关于GensSci098注射液获得临床试验批准通知书的公告. (2024). Retrieved from https://www.gensci.cn/news/20240924
[7] 橙帆医药关于VBS-102双特异性抗体海外授权及融资的公告. (2025). Retrieved from https://www.velavigo.com/news/20250917