文献解析
头颈部鳞状细胞癌(HNSCC)是头颈部最常见的恶性肿瘤,肺是HNSCC患者最常见的远处转移部位。肿瘤远处转移是一个时空循序渐进的过程,原发性肿瘤在转移前可以预先在远处组织重塑局部免疫微环境,从而塑造肿瘤转移前生态位,其中免疫抑制性巨噬细胞浸润是转移前生态位的鲜明特征之一。
文献来源

近日,上海交通大学医学院附属第九人民医院何悦教授、张建军研究员和郭海艳副主任团队在《Cancer Immunology Research》杂志上发表了题为"肿瘤来源的RAB21+ABHD12+sEVs驱动肺部转移前微环境形成”的研究论文。
该研究利用细胞和动物模型,揭示了携带 RAB21的小细胞外囊泡 (sEVs) 会归宿于肺巨噬细胞,并与巨噬细胞上的整合素-β1相互作用。本研究发现,来自头颈鳞癌的RAB21+ABHD12+ sEVs有助于转移前生态位中免疫抑制微环境的形成,并且是提高抗PD-1疗法抗肿瘤效果的潜在治疗靶点。
项目研究
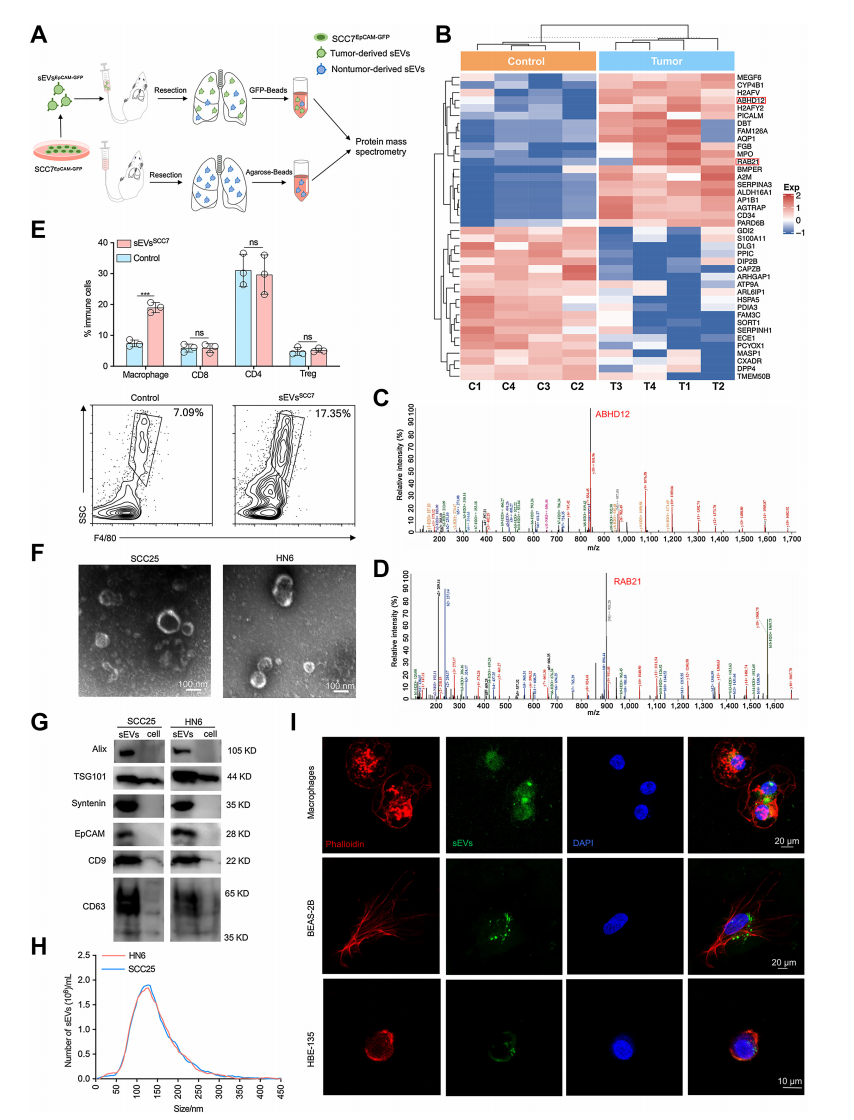
HNSCC来源的sEVs被巨噬细胞吞噬
作者首先评估了HNSCC来源的sEV在促进肺转移前生态位形成中的作用。
通过从小鼠HNSCC细胞系分离sEVs并注射到小鼠体内,观察24小时,使用质谱进行分析,结果显示注射sEVs后,小鼠肺中分离的外源sEVsEpCAM-GFP中的蛋白质存在差异表达。注射后24小时,巨噬细胞的百分比显著增加,而CD8+、CD4+和Treg细胞的百分比没有显著变化。
通过将生理盐水(对照)、SCC7来源的sEVs (sEVsSCC7)和正常上皮来源的sEVs (sEVsNormal)注射到尾静脉,结合流式细胞术、透射电镜验证了巨噬细胞的增加是由于局部肺巨噬细胞增殖,并且仅限于肿瘤来源的sEVs;
通过免疫印记和纳米颗粒跟踪分析等方法验证了sEVs的形态和表面标志物,并筛选出ABHD12和Rab21为差异蛋白,最后通过共孵育实验发现肿瘤来源的sEVs被巨噬细胞内化。这些结果表明,肿瘤来源的sEVs可能在巨噬细胞中发挥重要作用,参与肺转移前生态位的形成。
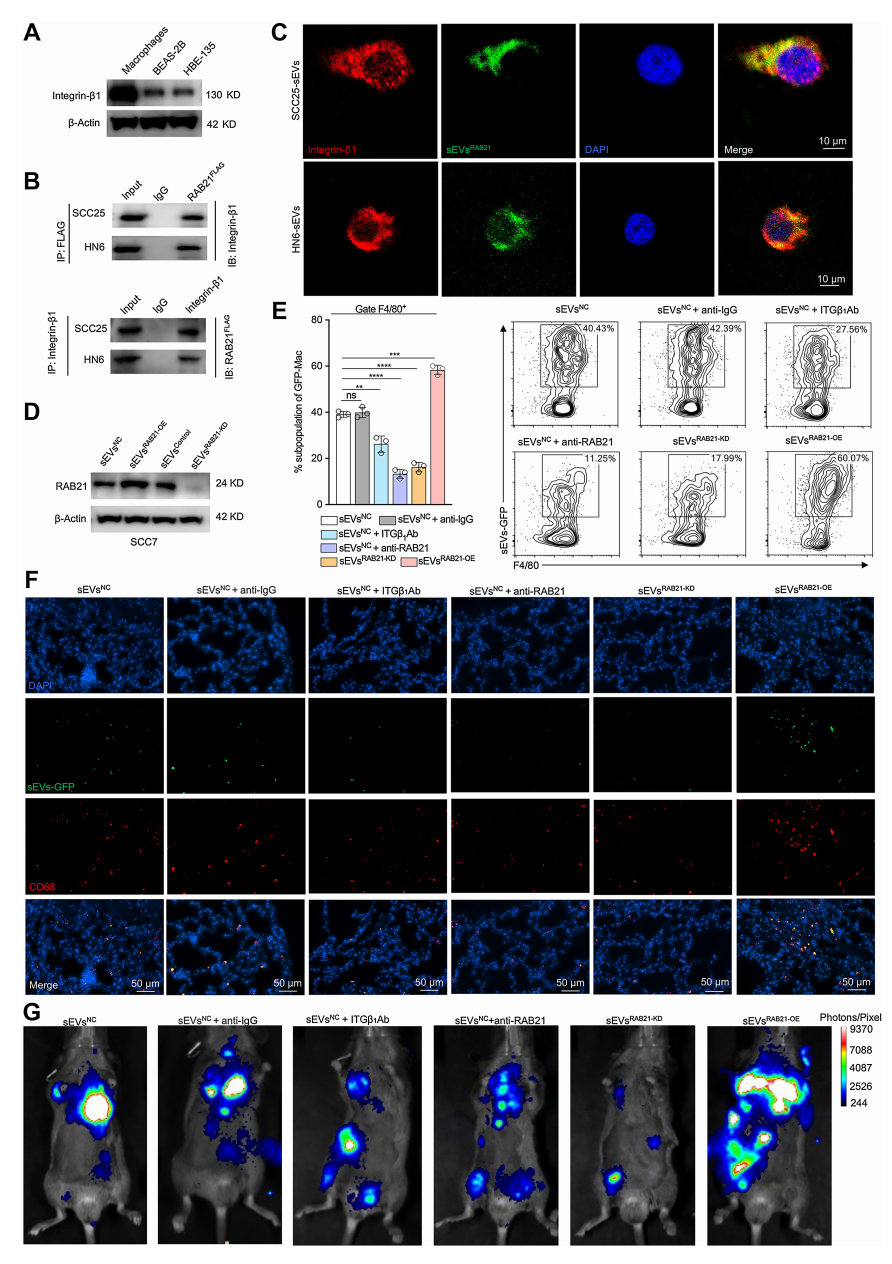
HNSCC来源的sEV通过RAB21/ integrin-β1进入肺巨噬细胞
sEVs靶向具有高度血管化的组织,如肺,主要通过它们的表面整合素蛋白。
RAB21是Rab蛋白家族中的一员,参与细胞内吞途径,过往研究提示内源性integrin-β1与RAB21存在共定位互作。因此,作者研究了sEVs上的RAB21和巨噬细胞上的integrin-β1之间的相互作用,通过一系列实验,证实RAB21与integrin-β1存在直接结合关系,且integrin-β1在巨噬细胞中的表达显著高于肺上皮细胞系。
通过将不同处理的sEVs注射到小鼠体内进一步验证这一结果,发现sEVsRAB21-OE能增强巨噬细胞中EpCAM-GFP信号,而sEVsRAB21-KD、分别阻断ITGβ1或RAB21后,小鼠巨噬细胞中EpCAM-GFP信号减弱。
此外,作者还发现sEVs通过重塑转移前生态位促进器官特异性转移行为并验证了sEVs对靶器官功能状态的影响。上述结果表明,sEVsRAB21与巨噬细胞上的integrin-β1相互作用,使HNSCC来源的sEVs归巢到肺部巨噬细胞,从而促进转移。
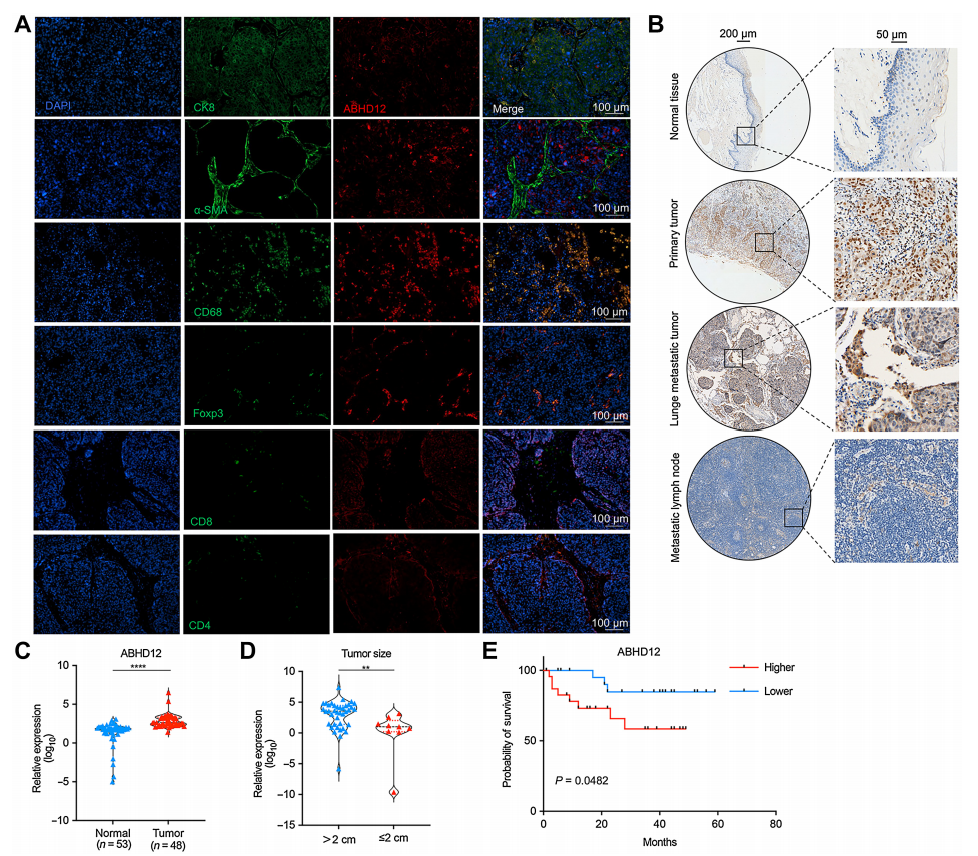
ABHD12与巨噬细胞共定位并促进HNSCC的恶化
对患者样本进行染色,作者发现并证实了ABHD12主要定位于巨噬细胞,表明肺转移瘤中巨噬细胞与ABHD12具有相关性。临床样本的结果也提示了,ABHD12的表达高于正常口腔上皮组织或转移淋巴结组织,且肺转移瘤中ABHD12的表达最高;
与正常口腔黏膜样本相比,ABHD12在HNSCC中的表达显著增加,并于患者的不良预后密切相关。同样,TCGA数据分析进一步证实了ABHD12在HNSCC中的高表达,并且巨噬细胞中ABHD12的表达与M2型巨噬细胞浸润呈正相关。这些结果表明ABHD12可能在肺转移中发挥关键作用。
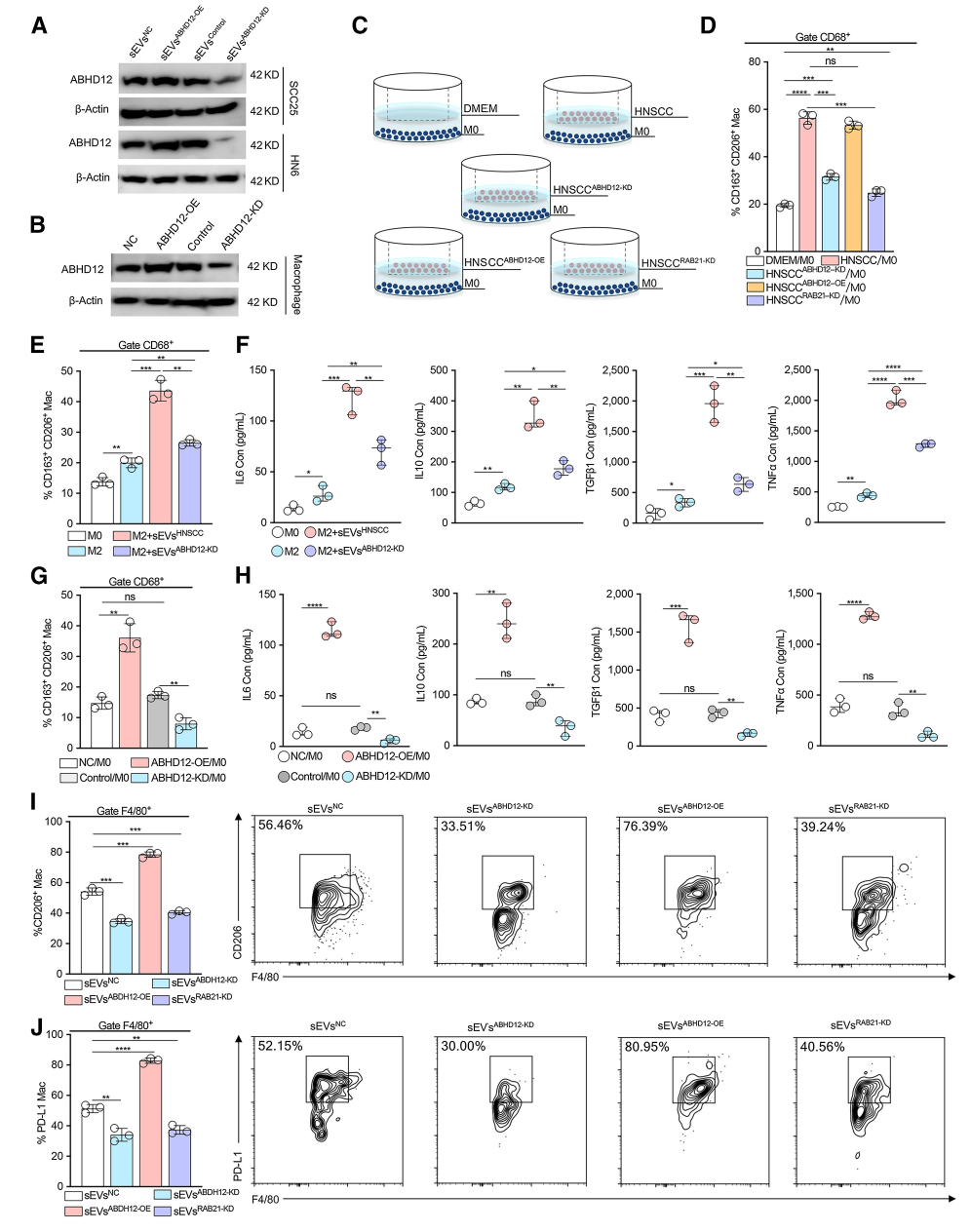
HNSCC来源的sEVs通过ABHD12调节巨噬细胞介导的免疫抑制
前期结果表明,在HNSCC患者肺转移瘤中,ABHD12表达上调与TAMs相关。
因此,进一步探索了HNSCC来源的sEVs中的ABHD12对巨噬细胞功能的影响。结果表明,HNSCC细胞促使共培养体系中M2型巨噬细胞比例增加,而在HNSCCABHD12-KD细胞共培养体系中M2型巨噬细胞比例下降,表明sEVs携带的ABHD12可诱导巨噬细胞呈现M2表型。上述结果表明,高表达ABHD12的sEVs可将巨噬细胞转化为恶性表型,并促进转移前生态位的形成。
HNSCC 来源的 sEV 中的 ABHD12 通过驱动转移前生态位的形成来促进肺转移
为了进一步评估 sEVsABHD12在促进肺转移中的作用,将SCC7来源的 sEVs(sEVsNC、sEVsABHD12-KD、sEVsABHD12-OE 和 sEVsRAB21-KD)每3天注射到小鼠体内,结果显示sEVsABHD12-OE组小鼠体重显著下降,增强肿瘤肺转移,并且M2巨噬细胞数量和巨噬细胞PD-L1表达增加,加速CD8+T细胞的耗竭。
此外,研究还发现,活化的CD8+T细胞在sEVsABHD12-OE组中受到抑制。这些发现表明,HNSCC来源的sEVs中的ABHD12通过重塑转移前生态位来促进肺转移。
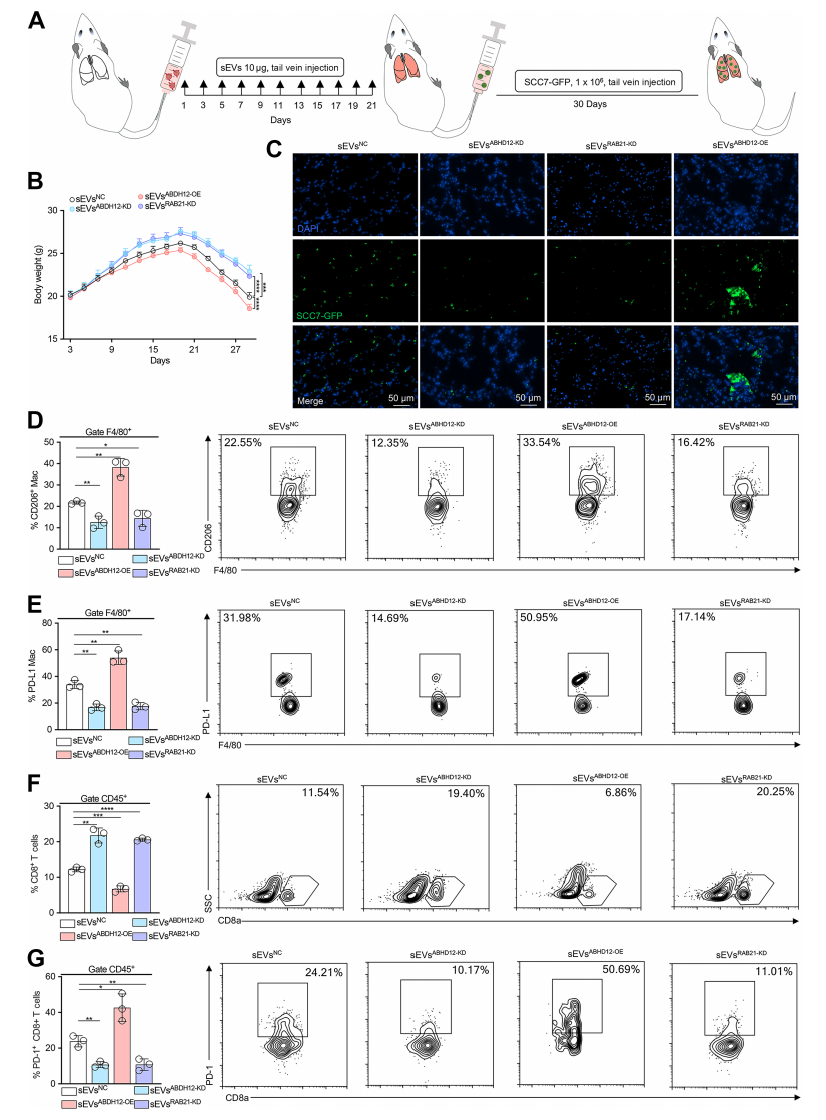
ABHD12通过FoxO1途径调节TAMs的功能
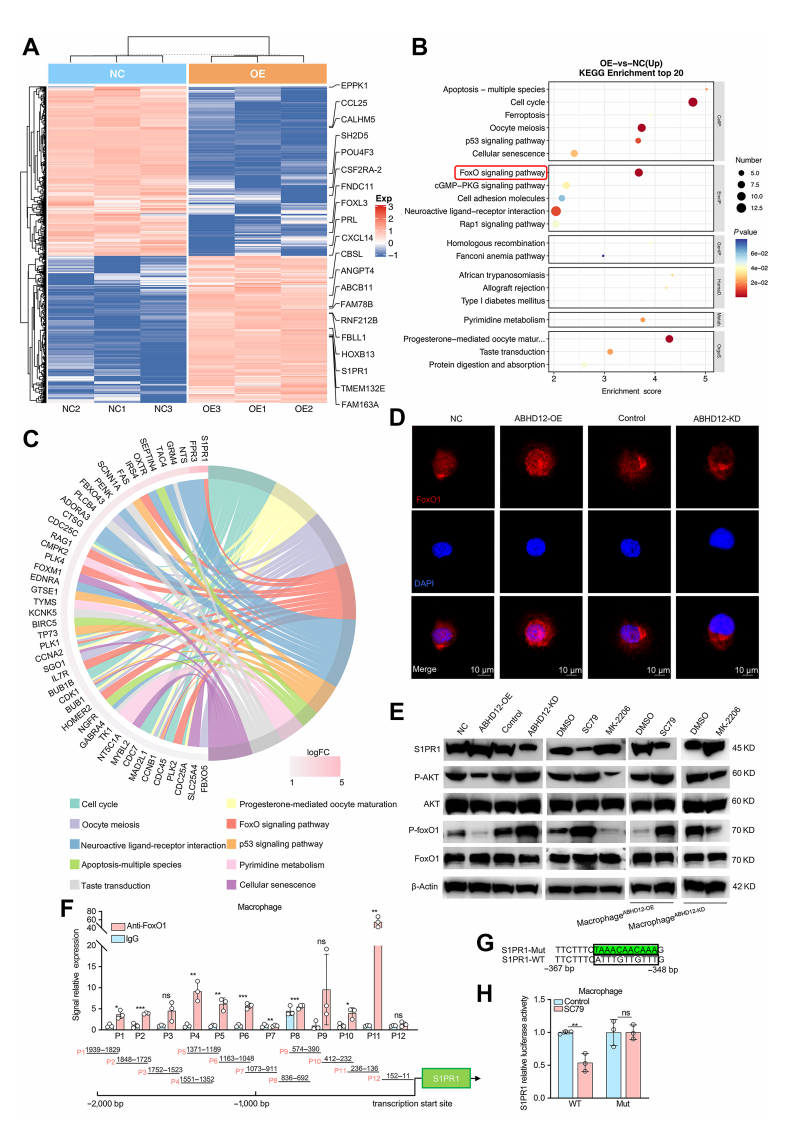
使用RNA测序探究过表达ABHD12造成的差异,结果显示,包括S1PR1在内的766个差异基因参与了ABHD12对巨噬细胞的调控。
使用KEGG分析探究ABHD12调节S1PR1表达的信号通路,并证实 FoxO信号通路显著富集并且与S1PR1相关。此外,在过表达ABHD12的巨噬细胞中,FoxO1定位于细胞核,而在敲低ABHD12的巨噬细胞中则提示FoxO1的核转位,该效应则依赖AKT通路。用 AKT 抑制剂和激动剂处理巨噬细胞,结果表明,ABHD12通过调节AKT-FoxO1通路来调节S1PR1的表达,从而影响巨噬细胞的免疫抑制极化。
靶向S1PR1可能增强抗PD-1治疗的抗肿瘤效果
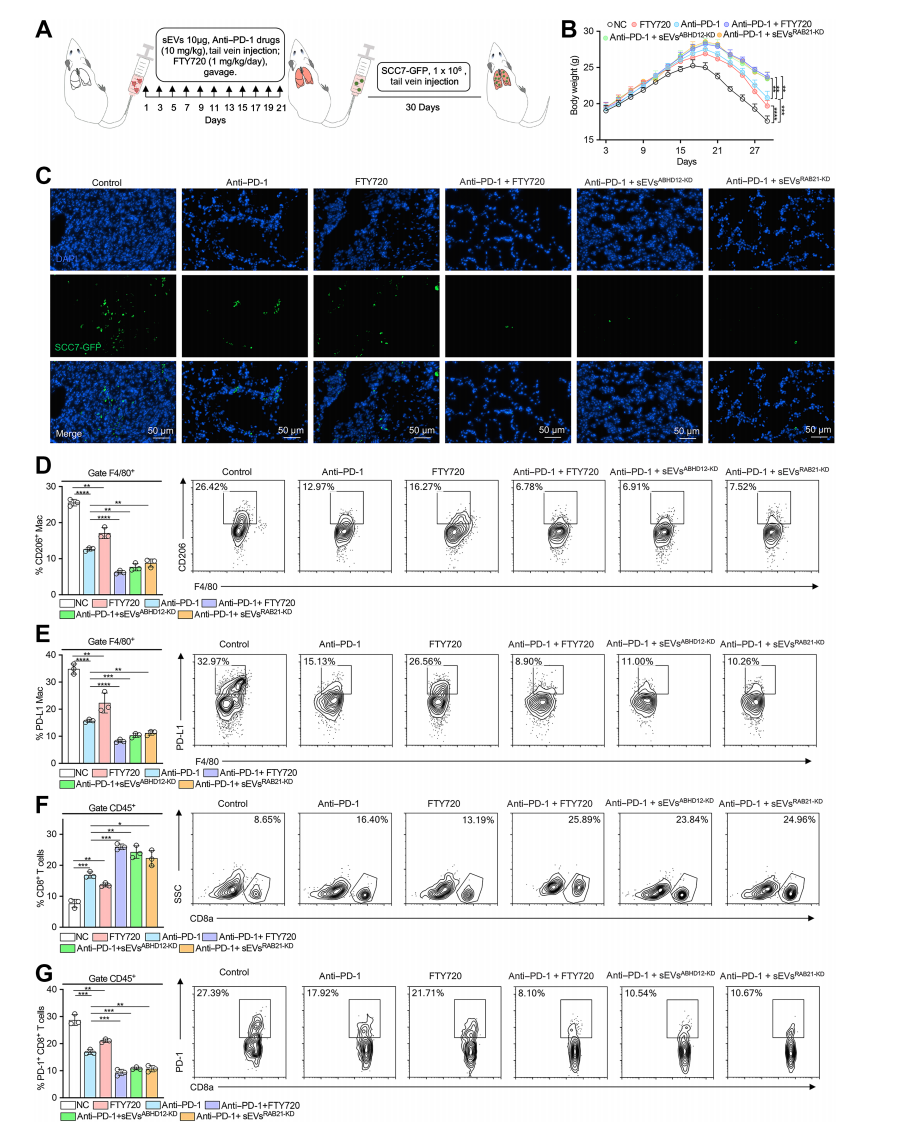
为了探讨sEVsABHD12在免疫治疗中的作用,将抗PD-1抗体、FTY720、sEVsABHD12-KD和sEVsRAB21-KD注射到sEVsSCC7小鼠体内。
3周后,通过尾静脉注射1x106个SCC7GFP细胞,发现FTY720和抗PD-1抗体具有显著的抗肿瘤效果,且联合治疗的效果更佳。同时,当敲除sEVs中的RAB21和ABHD12时,抗PD-1治疗的肺转移减少。
此外,实验还发现FTY720和抗PD-1治疗可以减少M2巨噬细胞浸润,增加CD8+T细胞数量,并减少PD-L1的表达。这些结果表明,S1PR1是提高抗PD-1抗肿瘤疗效的潜在治疗靶点。
研究结论
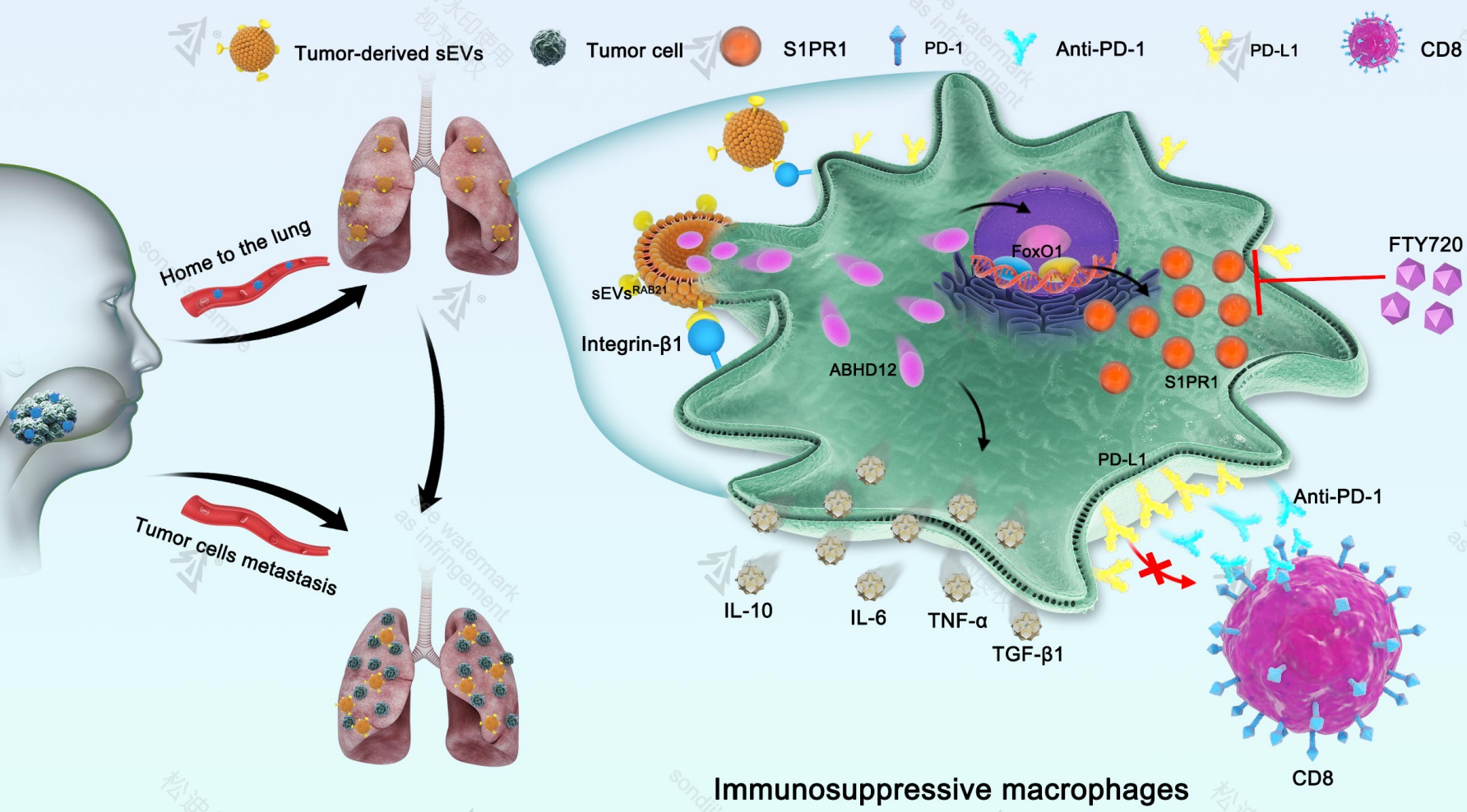
该研究首次阐明了头颈鳞癌细胞来源的外泌体促进肺转移的分子机制。
研究发现,头颈鳞癌细胞来源的RAB21+ABHD12+sEVs可以被肺部的巨噬细胞摄取,EVs上的RAB21通过与巨噬细胞膜上的integrin-β1直接结合,介导巨噬细胞对外泌体的内化过程;而EVs上的ABHD12蛋白则进一步诱导巨噬细胞分化为M2型并高表达S1PR1蛋白,塑造转移前的免疫抑制微环境,促进头颈鳞癌肺转移的发生。此外,使用PD-1单抗联合FTY720(S1PR1抑制剂)可以显著抑制头颈鳞癌细胞肺转移的发生。
文章示意图
吉满助力
本研究中所用的ABHD12和RAB21的过表达和敲低质粒均由吉满生物提供。了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。
欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
















