2025 年 7 月 17 日,专注于精准免疫肿瘤药物研发的全球性生物技术公司I-Mab宣布达成最终协议,收购 Bridge Health Biotech Co., Ltd.(Bridge Health)100% 股权。
此次交易将为I-Mab带来其 CLDN18.2×4-1BB 双特异性抗体 givastomig 所使用的 CLDN18.2 亲本抗体在双特异性及多特异性应用(包括双抗、多抗和抗体药物偶联物 ADC)方面的上游权利,进一步巩固 givastomig 的知识产权护城河。
Givastomig是一款CLDN18.2/4-1BB双特异性抗体,采用条件性激活设计,只有在与Claudin18.2结合时才会激活4-1BB通路,且避免了系统性毒性风险。
近期,I-Mab于ESMO GI大会上公布了Givastomig联合PD-1抑制剂及化疗治疗一线胃癌的1b期剂量递增研究数据,关键数据表现如下:
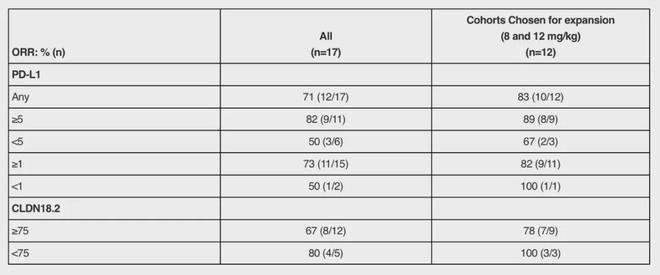
整体客观缓解率(ORR)为71%,17例患者中有12例达到部分缓解。在8mg/kg和12mg/kg的推荐剂量组中,ORR更是达到了83%(10/12)。疾病控制率在三个剂量水平下均为100%。
值得注意的是,Givastomig在不同表达水平的患者中都显示出了活性。在CLDN18.2表达<75%的患者中,ORR为80%,而在推荐剂量组中这一比例达到了100%。这意味着即使是低表达的患者群体也能从中获益。
从持久性来看,截至数据截止日期,17例患者中有8例仍在接受研究治疗,最长治疗持续时间为11.3个月,显示出了不错的治疗持久性。
安全性方面,研究中未观察到剂量限制性毒性,常见的治疗相关不良事件多为1-2级,包括恶心、呕吐、疲劳等,3级以上不良事件较为罕见。
从数据来看,71%的整体ORR确实高于目前已上市的zolbetuximab单抗(约40-50%),而且在安全性方面没有出现4-1BB类药物常见的细胞因子释放综合征,这对于这类药物来说是个不错的表现。
值得一提的是,这次发布的是17例患者的1b期剂量递增阶段结果。根据I-Mab的临床规划,剂量扩展阶段正在进行中,预计明年上半年将公布更大样本量的数据,尤其是此次83% ORR的推荐剂量组的完整结果。如果后续数据能够保持这一水准,将进一步验证Givastomig的临床价值。
胃癌CLDN18.2靶点目前竞争确实激烈,除了已上市的zolbetuximab,还有多款ADC产品在研发中。在这样的环境下,Givastomig能交出71%的整体ORR和83%的推荐剂量组ORR数据,至少证明了差异化技术路线的价值。
需要说明的是,Givastomig的权益分配比较特殊。I-Mab和韩国ABL Bio共同拥有除中国之外的全球权益,而中国权益则属于天境生物(TJ Biopharma)。这种分配方式意味着三家公司都能从这款产品未来的成功中受益。
中国作为全球最大的胃癌市场,每年新发胃癌患者约40万例,占全球胃癌患者的近一半。考虑到庞大的患者基数和未满足的医疗需求,不排除Givastomig接下来在中国开展多中心研究的可能性。对于天境生物而言,拥有这款产品在中国市场的独家权益,商业价值想象空间巨大。
资料来源:
1.https://www.i-mabbiopharma.com/news-releases/news-release-details/i-mab-highlights-positive-givastomig-phase-1b-dose-escalation
2.https://mp.weixin.qq.com/s/RKi1muSKdORhZWbkuWt6JA