文献解析
头颈部鳞状细胞癌(HNSCC)以肿瘤免疫微环境(TIME)异质性为特征。其中,肿瘤相关巨噬细胞(TAMs)主要参与恶性肿瘤进展中的关键调节过程。SPP1+巨噬细胞(SPP1+Macs)在许多癌症中都有发现,但它们对头颈部鳞状细胞癌的影响尚不清楚。
文献来源
近日,上海交通大学医学院附属第九人民医院张建军研究员和郭海艳副主任团队在《Journal of Experimental & Clinical Cancer Research》杂志上发表了题为"SPP1+巨噬细胞通过分泌 TNF-α和IL-1β促进头颈部鳞状细胞癌发展”的研究论文。
该研究利用单细胞测序、临床样本和细胞共培养模型,揭示了SPP1+巨噬细胞促进头颈鳞癌进展的机制,本研究发现SPP1+巨噬细胞可以释放细胞因子TNF-α和IL-1β从而促进肿瘤进展,并且这两种细胞因子同时可以促进SPP1的表达。
项目研究
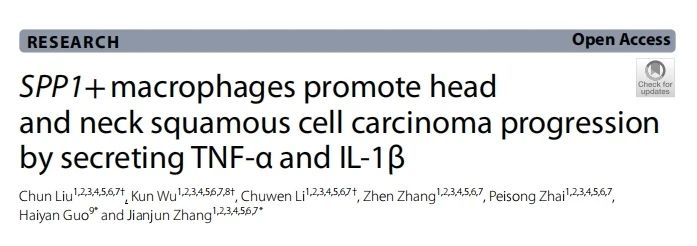
使用单细胞测序在HNSCC临床样本中鉴定出肿瘤特异性SPP1+Macs
使用正常和肿瘤组织进行单细胞RNA测序,经过质控和降维聚类后获得9种细胞类型。进一步分析HNSCC的肿瘤免疫微环境,结果提示髓系细胞具有较为显著的差异。对髓系细胞进行降维聚类,结合细胞通讯结果,我们发现,SPP1+Macs在肿瘤中显著上调,提示其在HNSCC进展中可能发挥重要作用。
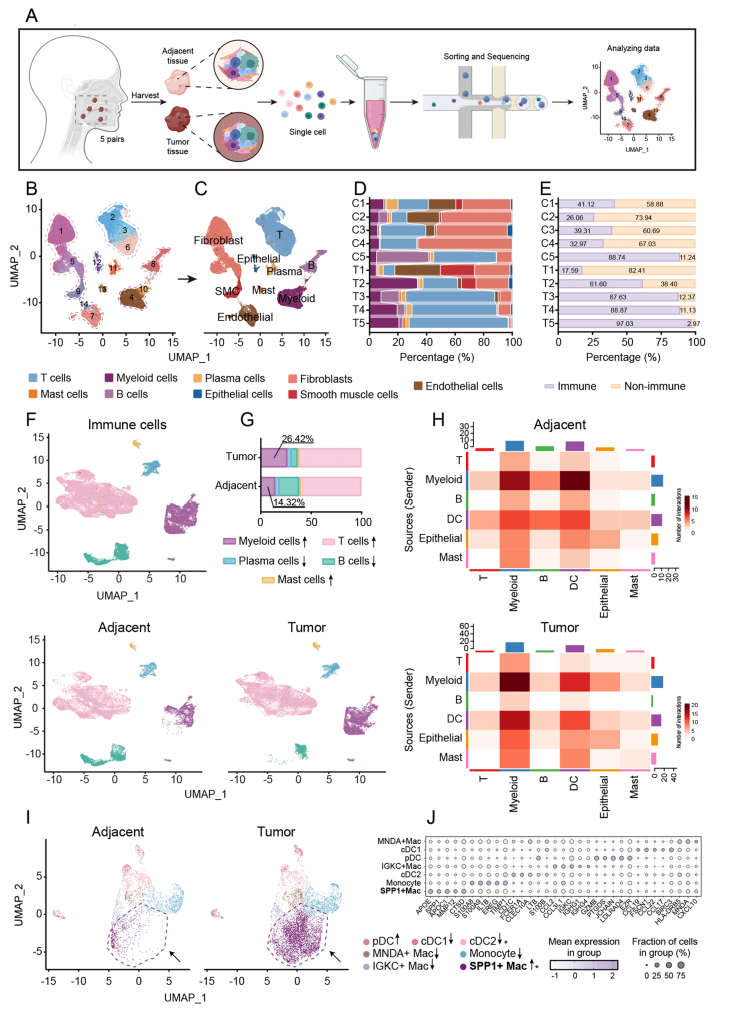
肿瘤特异性SPP1+Macs与HNSCC不良预后呈正相关
对SPP1基因进行进一步分析,单细胞测序数据证实了SPP1在髓系细胞基因中的高表达,且主要与SPP1+Macs亚群共定位。使用临床样本证实了SPP1在肿瘤中主要与巨噬细胞共定位,且SPP1、SPP1+Macs在肿瘤样本中显著高表达且与肿瘤进展相关。TCGA数据库结果也证实了该结论,并且发现SPP1及SPP1+Macs高表达的患者均提示预后较差及生存率较低。上述结果提示了SPP1作为预后生物标志物的潜在价值。
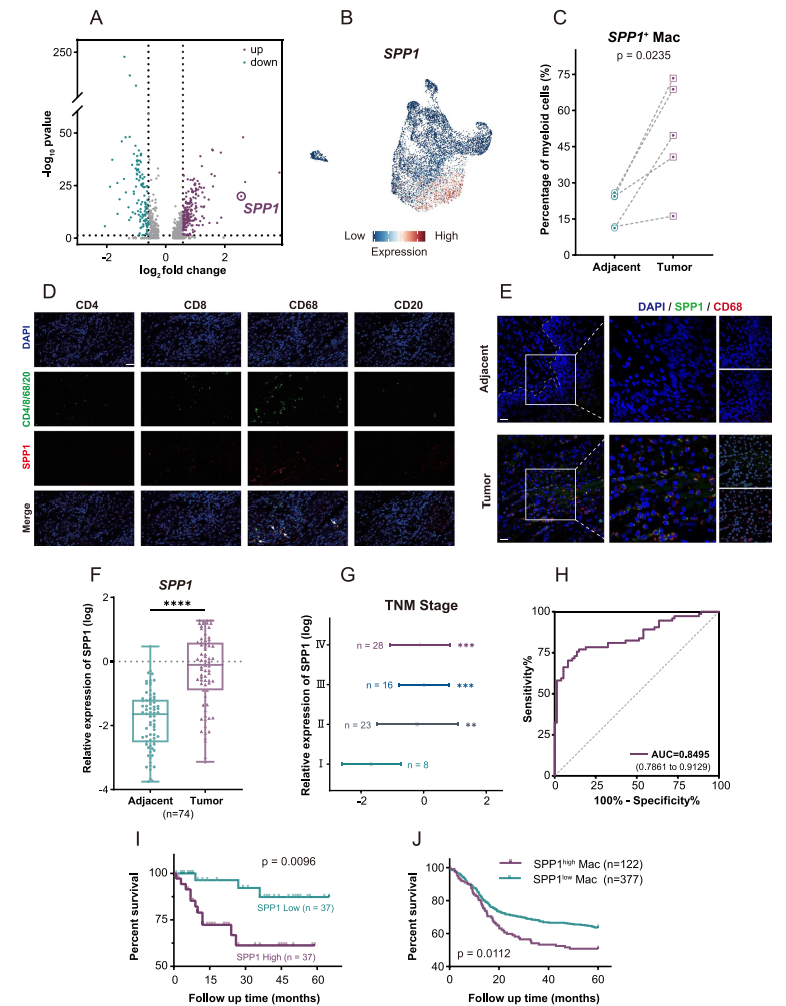
SPP1+Macs通过分泌细胞因子促进HNSCC进展
为了评估SPP1+Macs如何在HNSCC进展中发挥作用,使用GSVA分析得到了可能与细胞因子分析相关。使用慢病毒构建了正常、过表达(OE)、敲低(KD)的THP-1细胞株,并诱导为巨噬细胞进行后续验证。结果表明,过表达SPP1的巨噬细胞可以促进肿瘤细胞的增殖和迁移能力。
进一步使用Luminex液相悬浮芯片检测过表达SPP1的巨噬细胞中高表达的细胞因子。结果表明,MIF、TNF-α和IL-1β是在SPP1+Macs中上调最显著且高表达的基因。因此后续研究聚焦于这三种细胞因子。
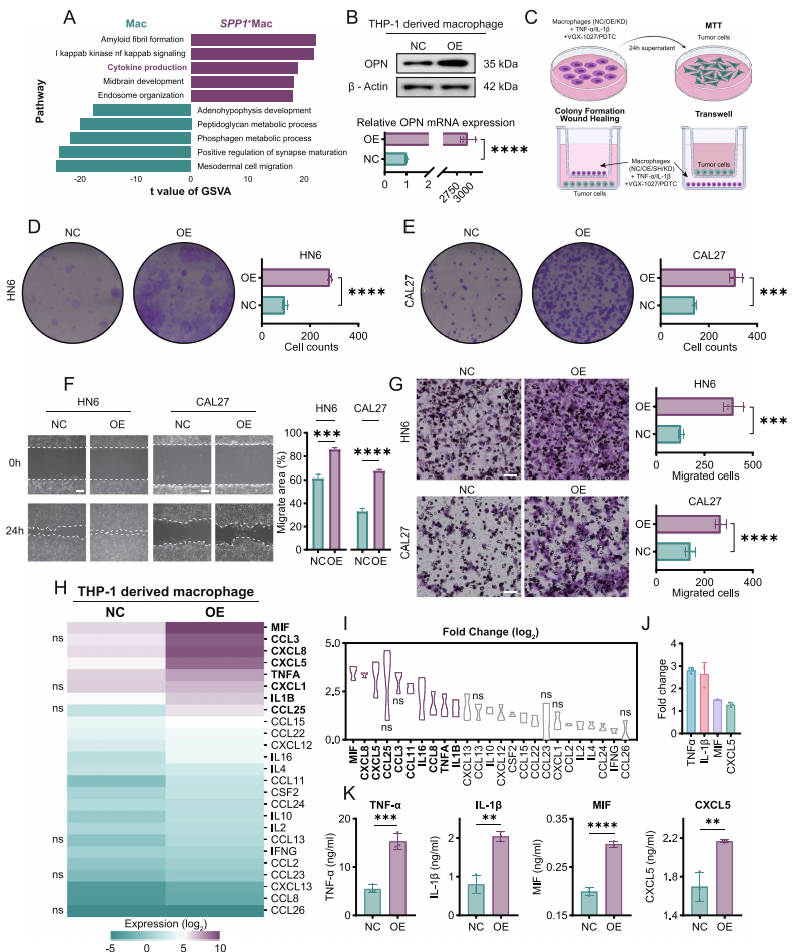
SPP1+Macs来源的TNF-α和IL-1β促进了HNSCC细胞的增殖和迁移
使用重组蛋白、靶向巨噬细胞的分泌TNF-α和IL-1β的抑制剂结合过表达和敲低SPP1的细胞株进行进一步探究。直接和间接共培养实验证实了SPP1+Macs来源的TNF-α和IL-1β促进了HNSCC细胞的增殖和迁移。
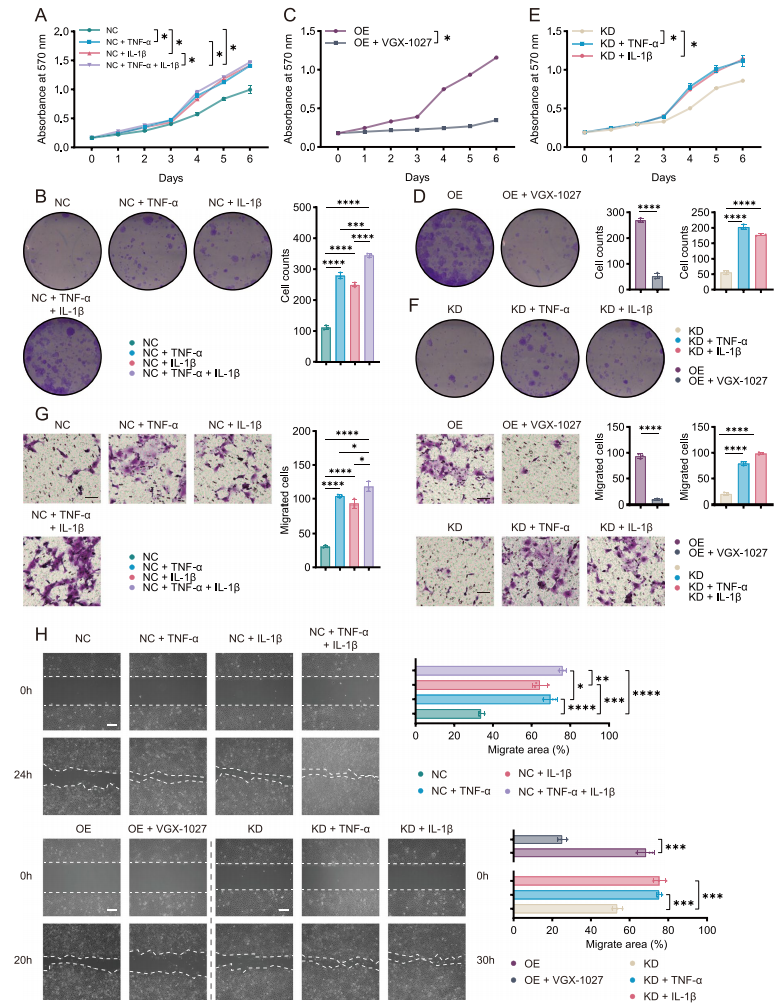
SPP1+Macs来源的TNF-α和IL-1β受NF-κB信号通路调控
过往文献提示SPP1、TNF-α和IL-1β与NF-κB存在关联,探究并验证过表达SPP1的巨噬细胞中是否存在NF-κB通路的激活。使用NF-κB通路的抑制剂PDTC,结合免疫印记、细胞荧光等实验证实了过表达SPP1的巨噬细胞中存在NF-κB通路的激活。进一步实验表明,PDTC可以抑制SPP1+Macs来源的TNF-α和IL-1β对肿瘤细胞增殖和迁移的促进作用。总之,该部分结果表明,SPP1+Macs通过激活NF-κB信号通路促进了TNF-α和IL-1β的表达和分泌。
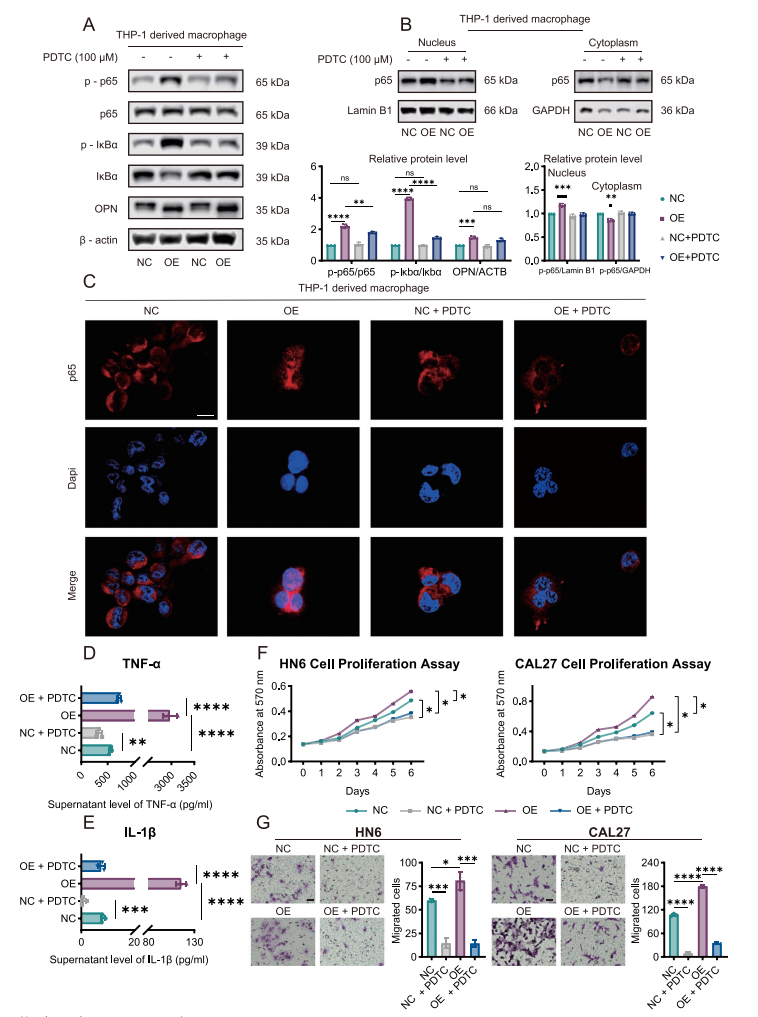
SPP1+Macs来源的TNF-α和IL-1β促进巨噬细胞和肿瘤细胞中OPN的表达
为了进一步探索SPP1+Macs来源的TNF-α和IL-1β如何促进头颈部鳞状细胞癌的进展,使用TNF-α和IL-1β重组蛋白处理HNSCC细胞系。结果表明,TNF-α和IL-1β在肿瘤细胞中激活NF-κB通路促进肿瘤进展,并且可以在肿瘤细胞中促进OPN蛋白的表达。同样,我们发现,TNF-α和IL-1β在巨噬细胞总也可以促进OPN的表达。
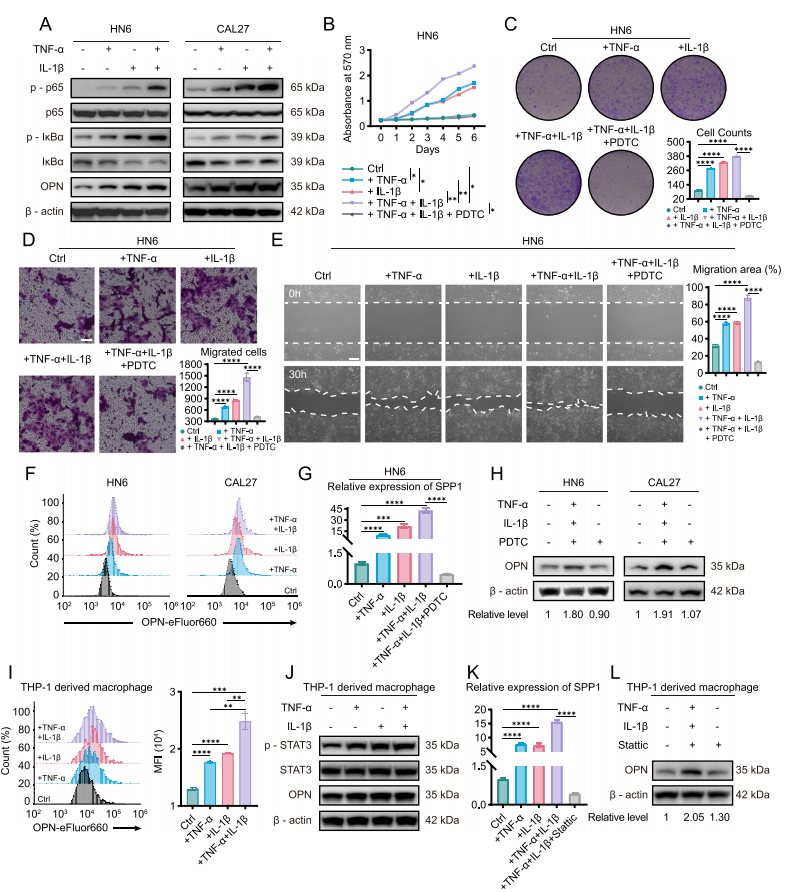
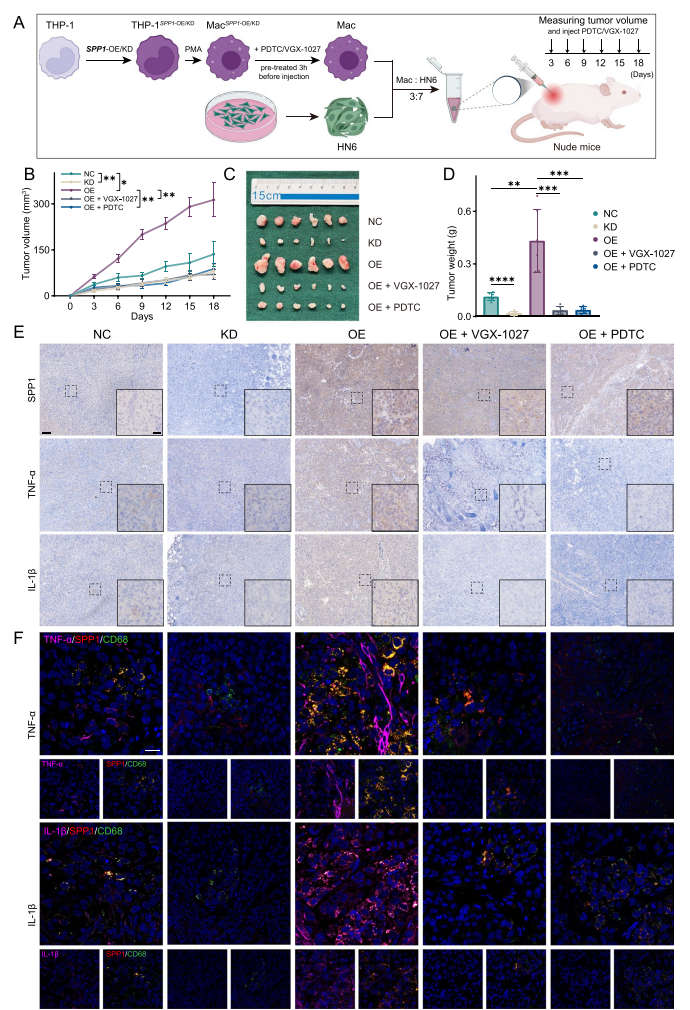
SPP1+Macs在体内促进了HNSCC的进展
使用HN6与THP-1来源的巨噬细胞在裸鼠中构建荷瘤模型,分别使用过表达(OE)、敲低(KD)SPP1以及VGX-1027和PDTC,对小鼠进行不同处理。结果证实了,敲低SPP1、VGX-1027、PDTC均可抑制肿瘤进展。
此外,对皮下瘤进行多重免疫组化染色以探究OPN、TNF-α和IL-1β的表达水平。染色结果表明,敲低SPP1的巨噬细胞、PDTC可以抑制OPN、TNF-α和IL-1β的表达,VGX-1027可以抑制TNF-α和IL-1β的表达。该结果与体外实验的结果相一致。总之,这些数据表明SPP1+巨噬细胞通过激活NF-κB信号通路促进了细胞因子TNF-α和IL-1β的表达和分泌,从而促进HNSCC的进展。
研究结论
本研究验证并探究了SPP1+Macs在头颈部鳞状细胞癌恶性进展中的作用和功能。
研究发现,SPP1+Macs来源的TNF-α和IL-1β通过促进肿瘤细胞的增殖和迁移功能从而促进头颈部鳞状细胞癌的进展。从机制上讲,我们发现由于NFκB信号通路的激活,SPP1+Macs中的TNF-α和IL-1β表达上调。此外,SPP1+Macs来源的TNF-α和IL-1β通过不同的信号通路促进了肿瘤细胞和其他邻近巨噬细胞中OPN的表达。
SPP1+Macs可能是一个候选靶点,通过它能够增强抗肿瘤效果。
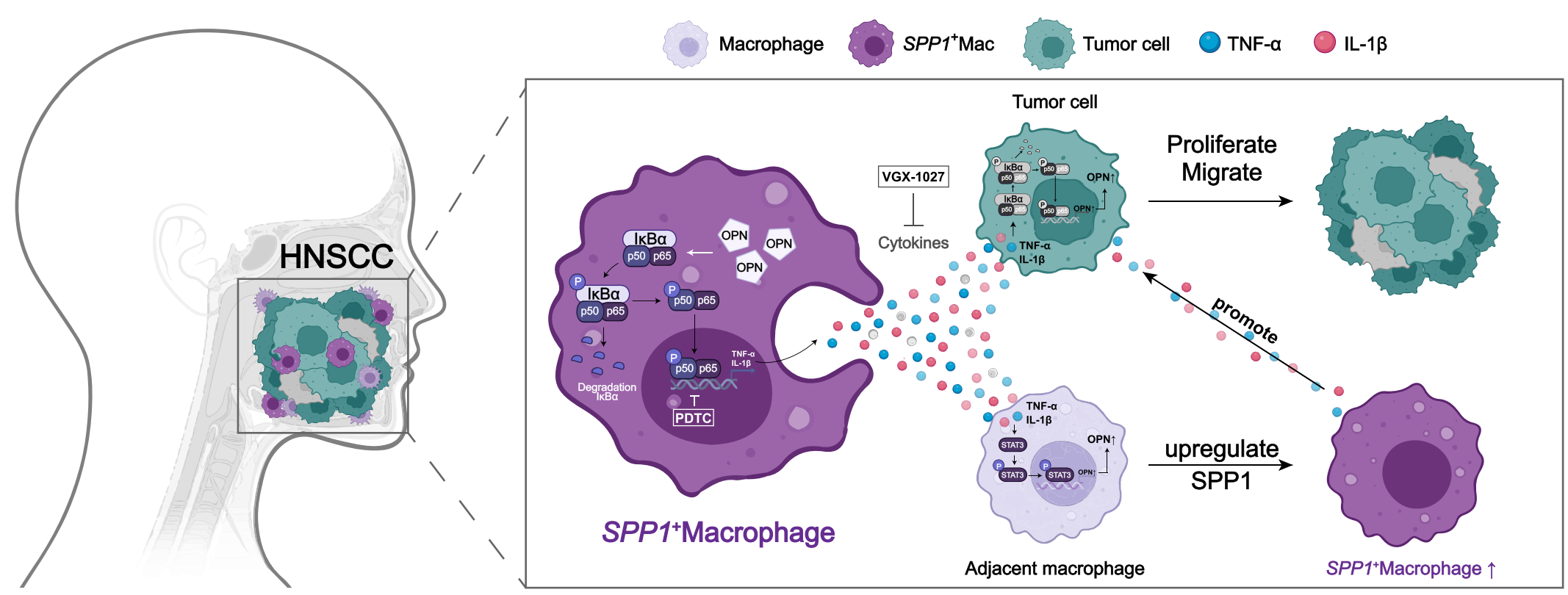
文章示意图
吉满助力
本研究中的SPP1过表达、SPP1敲降以及对照慢病毒载体均由吉满生物(Genomeditech)提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
原文引用
“The SPP1 overexpression, SPP1 knockdown, and control lentiviral vectors were constructed by Genomeditech Biotechnology Co., Ltd.”
文献原文
https://doi.org/10.1186/s13046-024-03255-w
文章来源:课题组供稿
















