circRNAs(Circular RNAs,环形RNA分子)是一类不具有5' 末端帽子和3' 末端poly(A)尾巴、并以共价键形成环形结构的非编码RNA分子。大量存在于真核转录组中。大部分的环状RNA是由外显子序列构成,在不同的物种中具有保守性,同时存在组织及不同发育阶段的表达特异性。由于环状RNA对核酸酶不敏感,所以比线性RNA更为稳定,这使得环状RNA在作为新型临床诊断标记物的开发应用上具有明显优势。此外,近期研究显示,环状RNA在不同物种中起到miRNA海绵的作用,称之为竞争性內源RNA(ceRNA),能竞争性结合miRNA,从而调控靶基因的表达。由此表明环状RNA可能通过竞争性结合疾病相关的miRNA在疾病调控中发挥着非常重要的作用。
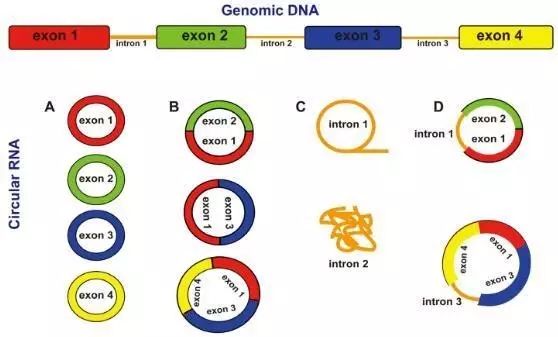
circRNA特征 (1)circRNA由特殊的可变剪切产生,大量存在于真核细胞的细胞质中,但少部分内含子来源的circRNA则存在于核酸内,具有一定的组织、时序和疾病特异性; (2)广泛存在于人体细胞中,有时甚至超过它们线性异构体的10倍之多; (3)与传统的线型RNA不同,circRNA分子呈封闭环状结构,不易被核酸外切酶RNaseR降解,比线性RNA更稳定; (4)具有高度保守性,部分具有快速的进化性改变; (5)大多数来源于外显子,少部分由内含子直接环化形成; (6)可以翻译成蛋白质,但大部分是非编码RNA 环状RNA的主要类型: 1、Annot_exon:环状RNA的breakpoint位于已知基因的一个外显子的起始和另外一个外显子的终止,其序列由breakpoint之间的外显子的碱基构成。 2、one_exon:环状RNA位于已知基因的某一个外显子内,其序列由breakpoint之间的所有碱基构成。 3、exon_intron:环状RNA的breakpoint之间有已知基因的一个或多个完成外显子但breakpoint不位于已知外显子的起始或终止,其序列由上breakpoint起始位点到第一个外显子起始位点、breakpoint之间的外显子和最后一个外显子到breakpoint终止位点的碱基构成。 4、Intronic:环状RNA位于已知基因的某一个内含子内,其序列由breakpoint之间的所有碱基构成。 5、Antisense:环状RNA位于已知基因的反义链,其序列由反义链上breakpoint之间的所有碱基构成。 6、Intergenic:环状RNA位于已知基因的之间,其序列由breakpoint之间的所有碱基构成。 环状RNA的形成机制 circRNA通过非经典剪接方式进行反向剪接形成。 一种模型认为pre-RNA 的转录过程中由于RNA发生了部分折叠,拉近了原本非相邻的外显子,从而发生了外显子跳跃( exon skipping ) ,使得被跨越的区域形成了环形RNA中间体,进一步通过套索剪接形成由外显子构成的环形RNA分子。 另一种模型认为,位于内含子区域的反向互补序列导致了内含子区域配对介导反向剪接从而形成环形RNA分子。 在接下来的步骤中, 这两种模型的过程基本一致, 即:剪接体(splicesome)切除剩余内含子和形成circRNA。 环状RNA的生物功能 A、circRNA顺式调控亲本基因的表达。 一方面,circRNA可以与RNA结合蛋白相互结合影响亲本基因mRNA的表达。 另一方面,环状RNA形成过程中内含子间竞争性互补配对可以与线性RNA之间达成一种平衡,影响mRNA的表达,甚至蛋白翻译。 B、环状RNA发挥竞争性内源RNA——ceRNA的作用吸附microRNA 2013年,两个研究团队在nature杂志上发文报道,CDR1基因起源的环状RNA(ciRS-7)可以结合吸附miR-7,从而降低miR-7的活性,间接上调miR-7相关靶基因的表达。由于环状RNA的稳定性,在机体内潜在对microRNA的吸附能力要强于线性的mRNA和lncRNA C、作为疾病的生物标注物? 环状RNA有较强的组织表达特异性,研究发现cANRIL 是一个从INK4A0ARF反义转录本,cANRIL的表达可能与INK4/ARF的转录和心血管硬化疾病风险相关。另外,研究人员发现has_circ_002059在胃癌中表达下调,是一个潜在的胃癌诊断的biomarker。黄胜林团队对肝癌细胞外泌体circRNA测序发现,circRNA在外泌体中大量富集且于正常细胞相比差异很大,同时血清中肿瘤circRNAs的富集程度甚至与肿瘤的大小有关。表明环状RNA是未来疾病诊断和治疗的潜在靶点。