文献解析

近日,中国科学院分子细胞科学卓越创新中心/上海科技大学孙兵研究员团队与新疆医科大学第一附属医院内分泌科杜国利教授团队合作在国际顶级肝病学术期刊《Hepatology》在线发表了题为“ECM1通过维持PCBP1介导的铁稳态在肝脂肪变性中发挥保护性作用(ECM1 Protects Against Liver Steatosis through PCBP1-mediated Iron Homeostasis)”的研究论文。
该研究发现,胞外基质蛋白ECM1通过调控细胞内铁代谢稳态,抑制脂质过氧化与氧化应激,从而显著改善MASH表型。研究进一步提出了“ECM1–PCBP1–铁代谢轴”在代谢相关肝病中的关键调控作用,拓展了对MASH发病机制的理解,并为其治疗提供了新的潜在靶点。
背景简介
随着生活方式和饮食结构的改变,代谢性疾病发病率持续上升,成为全球公共健康的重要挑战。
代谢相关脂肪性肝炎(MASH)
代谢功能障碍相关脂肪性肝病(MASLD)及其进展阶段-代谢相关脂肪性肝炎(MASH)是导致肝硬化及肝细胞癌(HCC)的主要原因之一,但当前仍缺乏有效治疗策略。
MASH 的典型特征包括肝脂质代谢紊乱、慢性炎症及氧化应激损伤,尤其是铁过载通过Fenton反应加剧脂质过氧化和细胞损伤,被认为是推动疾病进展的重要机制。然而铁稳态失衡的关键调控分子仍未明确。
胞外基质蛋白 ECM1
胞外基质蛋白 ECM1 是一种分泌型糖蛋白,广泛参与皮肤稳态、免疫调控及肿瘤发生。其在肝纤维化中可通过抑制TGF-β的激活发挥抗纤维化作用,但在MASH中的功能尚不清楚。
项目研究
通过分析ECM1敲除小鼠的肝组织转录组数据发现,与脂质代谢紊乱、炎症反应增强及铁死亡(ferroptosis)相关的通路显著上调,提示ECM1可能在调控肝脏代谢稳态中发挥重要作用。
在多种饮食诱导的MASH模型中(高脂饮食HFD、高脂高胆固醇HFHC和胆碱缺乏氨基酸MCD模型),肝组织中ECM1表达均显著下降。同时,人类MASH患者肝组织中,ECM1表达水平显著下降,且其表达量与NAS评分、气球样变即纤维化分级SAF评分呈显著负相关(图1)。
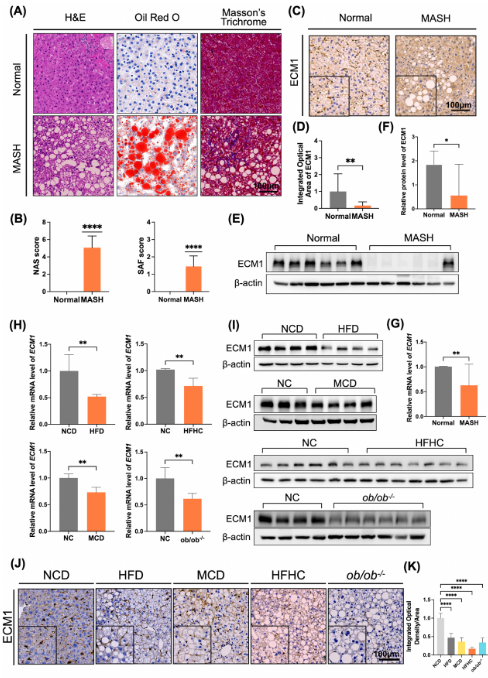
图1 ECM1和MASH疾病呈显著负相关
功能研究发现,肝实质细胞特异性敲除ECM1的小鼠显示,表现出更严重的脂肪变性、炎症反应及纤维化;相反,AAV介导ECM1在肝脏中过表达则可有效逆转上述病理表型,进一步证实其在疾病进展中的保护作用(图2)。
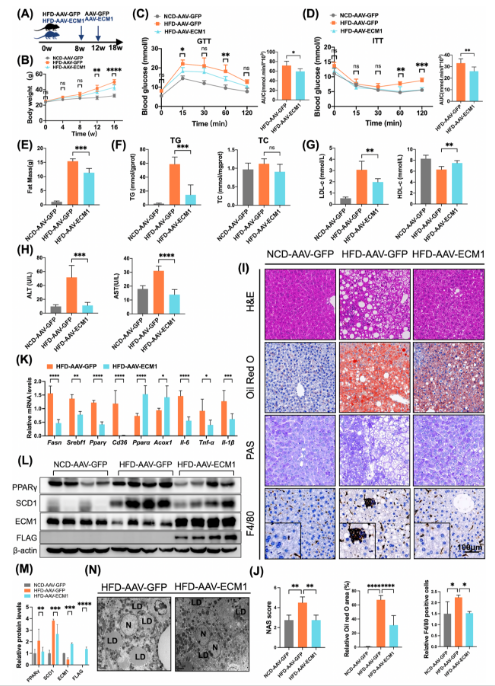
图2 肝特异性过表达ECM1显著缓解HFD诱导的肝脂肪变性和炎症反应
机制研究表明,ECM1可直接结合细胞内铁伴侣蛋白PCBP1的KH3结构域,增强其对Fe²⁺的结合能力,降低细胞内不稳定铁池水平,从而维持细胞内铁稳态,减少游离铁介导的活性氧(ROS)积累及脂质过氧化(LPO)反应。
体内外实验进一步证实,ECM1与PCBP1的联合过表达可显著缓解氧化应激相关的铁过载损伤,而在敲低PCBP1的背景下,ECM1的保护作用明显减弱。动物实验亦表明,ECM1过表达或PCBP1质粒注射均可有效缓解小鼠MASH的表型,提示该调控轴具备重要的生理功能及干预潜力(图3)。
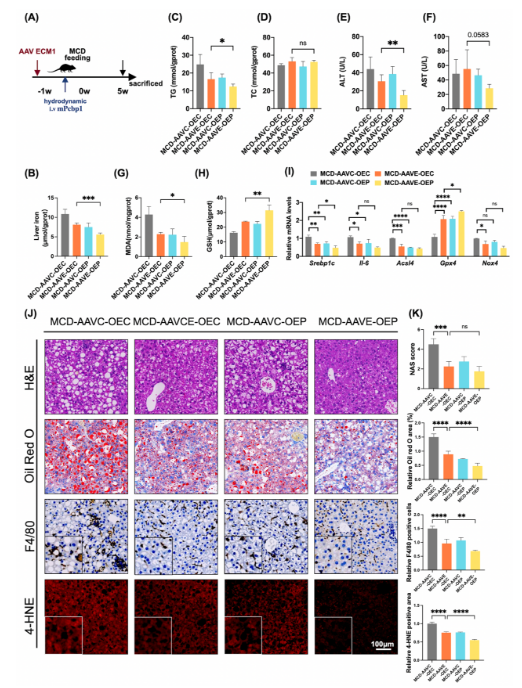
图3 ECM1和PCBP1相互作用抑制MASH相关的脂质过氧化与氧化应激
研究结论
综上,本研究首次揭示了ECM1在调控细胞内铁代谢和维持肝脏代谢稳态中的重要功能,为MASLD/MASH的治疗提供了全新的分子靶点,也为铁代谢与肝脏疾病关系的研究提供了新的视角。
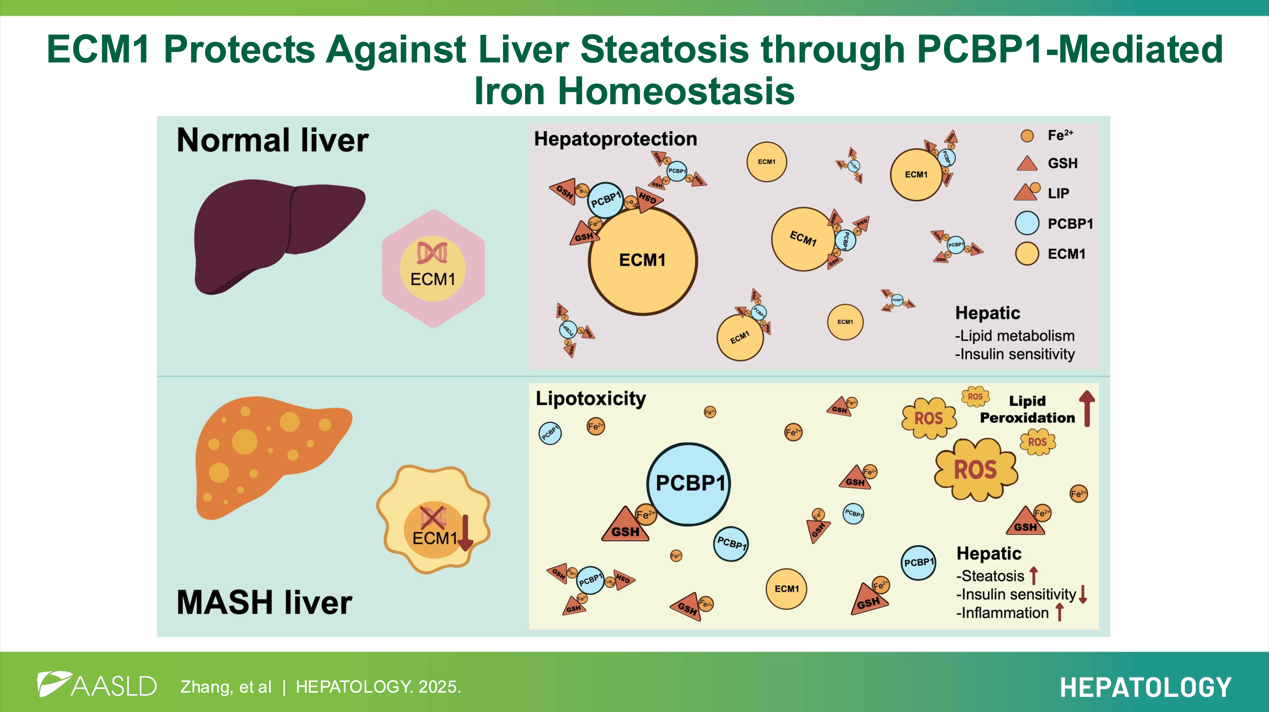
图4 ECM1在MASH中的作用机制示意图
吉满助力
本研究中所用的AAV8-mECM1、AAV8-PCBP1和AAV8–GFP均由吉满生物(Genomeditech)提供。
了解更多质粒构建,病毒包装,稳转株构建,敲除细胞株,报告基因检测等相关服务。
欢迎访问吉满生物官网:www.genomeditech.com
免费咨询电话:400-627-9288
原文引用
“For adeno-associated virus 8 (AAV8)- mediated gene delivery, mice received tail vein injections of AAV8–ECM1, AAV8–PCBP1, or AAV8–GFP (Genomeditech). ”
文献原文
https://pubmed.ncbi.nlm.nih.gov/40372944/
文章来源:课题组供稿
















